원소기호 C, 원자번호 6, 원자량 12.
주기율표에 자리 잡은 탄소의 신상명세서이다. 보통 ‘탄소’ 하면 숯과 연필심과 다이아몬드 정도를 떠올린다. 하지만 모든 생명에는 탄소 원자가 포함되어 있다. 대부분의 화합물 또한 탄소를 포함한다. 우리가 사용하는 도구치고 탄소가 없는 것은 거의 없다. 연필도, 펜의 잉크도, 콘크리트도, 석유와 천연가스도, 플라스틱도, 비닐도 모두 탄소로 이루어져 있다. 모든 물질은 왜 이렇게 탄소로 이루어져 있는 것일까.
탄소는 화합(化合)의 특성이 가장 강한 원소다. 산소와 수소가 결합하여 물이 되듯, 둘 이상이 결합하여 본래의 성질을 잃어버리고 새로운 물질을 만드는 특성을 가졌다. 탄소가 화합물을 잘 만드는 이유는 우주에서 수소(H), 헬륨(He), 산소(O) 다음으로 풍부한 데다, 가장 바깥쪽 원자 껍질에 공유결합을 할 수 있는 전자를 4개나 갖고 있기 때문이다. 바로 이 특성 덕분에 탄소가 다른 종류의 원소와 결합할 수 있다. 이게 무슨 말일까. 좀 더 쉽게 풀어보자.
사람에게 등뼈가 없다면 어떻게 될까? 일어서서 다니지도 못하고 오징어처럼 흐느적거리며 기어 다닐 수밖에 없다. 등뼈가 있기 때문에 거기에 목뼈가 붙어서 머리가 지탱되고, 엉덩이뼈가 붙고 다시 다리가 붙어서 걸어 다닐 수 있다. 가슴 부분의 등뼈에 가슴뼈가 다시 붙어서 폐와 심장을 보호한다.
마찬가지로 우리 몸을 이루는 성분에도 등뼈 같은 것이 있다. 바로 탄소다. 탄소는 여러 개가 쇠사슬처럼 어깨동무를 하고 있다. 그리고 마치 지네발처럼 탄소에서 발들이 나온다. 탄소는 손을 네 개(전자 4개)나 지니고 있다. 십자가를 연상하면 된다. 어떤 성분도 손이 네 개 이상인 것은 없다. 탄소는 원자 중에 손이 가장 많다. 사방으로 손을 뻗치고 있는 탄소는 무엇이든 잘 붙잡는다. 그래서 그 손끝에 각종 성분이 붙는다. 이때 탄소는 사슬 모양이나 고리 모양의 매우 안정적인 공유결합을 한다. 또 화학식이 같으면서도 성질이 다른 다양한 형태의 물질(이성질체)을 만들어낸다.
탄소화합물은 자연계에 존재하는 것과 인공적으로 합성한 것을 합치면 거의 1000만가지에 이른다. 다른 모든 원소가 만든 화합물을 더한 것보다 훨씬 많다. 탄소는 어떤 다른 원소보다도 많은 종류의 화합물을 만든다. 철의 경우, 탄소 함유량이 적으면 적을수록 연하고 늘어나는 성질이 커진다. 그 함유량이 많아짐에 따라 경도가 높아지고 강하게 되는 반면 부서지기 쉽고 늘어나는 성질은 줄어든다. 이렇게 탄소 함유량이 물질의 조직과 성질을 크게 변화시키는 경계의 역할을 하기도 한다.
등뼈가 없이는 사람다운 사람이 생겨날 수 없는 것처럼, 탄소가 없었다면 인간도 풀도 세상에 생겨나지 못했을지 모른다. 유전정보를 담은 DNA도 따지고 보면 탄소화합물이다. 호흡과 광합성 같은 생명현상도 탄소를 기반으로 한다. 이런 생명현상을 가능하게 해주는 태양에너지도 탄소를 촉매로 하는 핵융합 반응으로 생산된다. 탄소는 우리 생활과 밀접한 관계를 갖는 중요한 유기원소다. 따라서 탄소는 생명의 근원인 셈이다.
탄소는 구조와 성질이 아주 다른 여러 동소체로 존재한다. 동소체는 같은 탄소 원자로 되어 있지만 원자의 배열, 즉 구조가 달라 물성이 다른 원소를 지칭한다. 무정형 탄소(검댕이, 숯, 활성탄), 흑연, 다이아몬드는 오래전부터 잘 알려진 자연적 동소체이다. 인공적으로 만든 동소체로는 탄소 원자 60개가 축구공처럼 결합돼 있는 분자 풀러렌 등이 있다. 이들 원소는 원자의 배열 순서에 따라 물리적 특성이 다양하게 나타난다.
예를 들어 숯과 다이아몬드는 그 원소가 똑같은 탄소다. 하지만 하나는 검은 목탄 덩어리에 불과하고, 다른 하나는 찬란한 빛을 내는 보석이다. 탄소가 땅속 깊은 곳에서 높은 온도와 엄청난 압력을 견뎌내면 다이아몬드가 되고 그냥 타버리면 숯이 된다. 탄소 ‘carbon’은 목탄을 뜻하는 라틴어 ‘carbo’에서 따온 말이다.
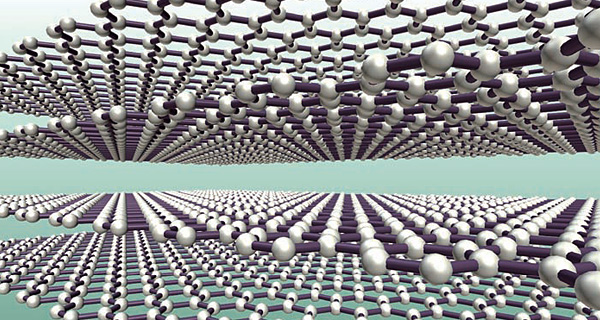
다이아몬드는 원자구조가 치밀한 1개의 단결정이다. 세상에서 가장 단단한 물질이다. 하지만 같은 탄소 분자로 만들어진 다결정 물질인 흑연은 연필심의 재료로 쓰일 만큼 무르고 잘 부러지는 재료다. 색깔도 투명한 다이아몬드와 정반대로 짙은 검은색을 띤다. 단결정과 다결정의 차이가 무엇이기에 이토록 성질이 다른 것일까.
물질의 최소단위는 원자다. 물질 고유의 성질을 결정하는 것은 ‘분자’다. 수소는 불이 잘 붙는 물질이고, 산소는 불이 붙을 때 꼭 필요하다. 하지만 수소원자 2개와 산소원자 1개가 모이면 오히려 불을 끌 수 있는 물 분자 1개가 되기도 한다. 이런 분자들은 다시 하나로 모여 ‘물질’을 형성하는데, 이런 분자들의 모임을 결정이라고 한다. 결정은 원자구조가 일정하게 배열된 단 한 개의 덩어리로 성장할 수도 있다. 이런 것을 ‘단결정’이라고 한다.
다시 말해 단결정은 내부의 구성 원자가 규칙적으로 배열된 순수한 고체이다. 하지만 대부분은 아주 작은 단결정 물질들이 계속 뭉쳐 다시 하나의 큰 결정으로 합쳐져 있다. 이런 경우를 ‘다결정’이라고 한다.
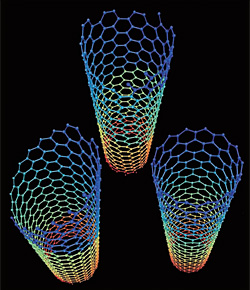
보통 다결정보다는 단결정이 더 강하다. 물질 고유의 성질을 최대한 발휘할 수 있다. 과학자들은 인위적으로 단결정 탄소화합물을 만들어 기존 재료의 단점을 뛰어넘는 소재를 개발하려고 하고 있다. 탄소 동소체의 여러 얼굴들을 가지고 과학자들이 마술사와 같은 첨단세계의 물질들을 만들어내고 있는 것이다. 최근에 나노기술을 탄생시킨 풀러렌, 탄소나노튜브, 그래핀의 출현이 그것이다.
‘꿈의 신물질’이라 불리는 이들 ‘탄소 3형제’는 다이아몬드보다도 강하다. 탄소가 늘어선 모양에 따라 구리선보다 전기가 잘 통하는 도체가 되기도 하고, 반도체가 되기도 한다. 이러한 독특한 성질 때문에 세상을 바꿔놓을 물질로 기대를 한몸에 받고 있다.
숯, 흑연, 다이아몬드, 탄소나노튜브. 네 가지 물질은 모두 탄소 원자들로 이뤄져 있다. 오직 한 종류의 원소로만 되어 있는 탄소. 그럼에도 불구하고 다양한 구조와 형태로 변신하는 천의 얼굴을 가진 물질, 그것이 바로 탄소의 정체이다.
