노인들에게 가장 큰 두려움을 안기는 질병 치매. 그중에서도 알츠하이머는 치매의 가장 흔한 형태이다. 75%의 치매 환자가 알츠하이머병이다. 알츠하이머병을 앓는 동안 겪는 삶의 질 하락은 비견할 병이 없을 정도로 끔찍하다. 이러한 알츠하이머병의 원인은 뇌 신경세포의 표면에 있는 베타 아밀로이드 단백질의 응집(플라크) 때문이라는 게 지금까지의 정설이다. 하지만 플라크가 치매의 발병 과정에 실제로 어떻게 작용하는지는 제대로 밝혀진 게 없었다. 그 비밀을 벨기에 루벤 가톨릭대학 연구팀이 밝혀내 세계 의학계의 주목을 받고 있다.
뇌 신경교세포서 2개 유전자 발현 유도
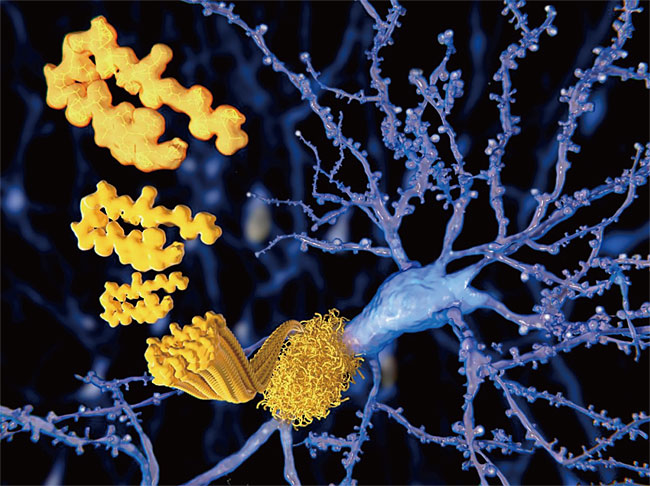
치매 원인과 관련해서는 몇 가지 단서만 그림자처럼 알려져 있다. 특히 과학자들이 지목한 알츠하이머 치매를 일으키는 주범 중 하나는 뇌의 특정 노폐물 단백질인 ‘베타 아밀로이드 플라크’다. 이는 당과 단백질이 뭉쳐진 덩어리다. 베타 아밀로이드의 원래 기능은 신경세포를 보호하는 것이다. 따라서 정상인의 경우에도 베타 아밀로이드 단백질이 소량 만들어지고, 이후 빠르게 분해돼 특별한 구조 없이 실처럼 풀린 형태로 뇌척수액에 녹아 있다.
그런데 이 단백질 유전자에 이상이 생기면 베타 아밀로이드가 비정상적으로 과다하게 생성돼 분해되지 않고 뇌세포 주변에 쌓이면서 딱딱한 플라크를 형성한다. 아밀로이드의 침적은 알츠하이머병의 증상이 나타나기 10년 내지 15년 전부터 시작된다. 반점처럼 생긴 덩어리인 아밀로이드 플라크는 뇌 신경세포 사이의 신호전달 시스템인 시냅스(synapse)를 교란시키고 파괴해 치매를 유발한다. 알츠하이머병을 진단할 때 베타 아밀로이드 플라크가 주요한 척도, 즉 바이오마커로 사용되는 이유가 여기에 있다.
알츠하이머병에서 베타 아밀로이드 플라크의 역할이 발견된 것은 1906년 무렵이다. 독일의 정신건강의학과 의사인 알로이스 알츠하이머(Alois Alzheimer)에 의해 처음으로 알려졌다. 하지만 1세기가 지난 지금도 플라크와 뇌의 알츠하이머 발병 과정 사이의 관계는 여전히 모호한 상태로 남아 있다. 그런데 지난 7월 22일(현지시각), 벨기에 루벤 가톨릭대학 플랑드르생명공학연구소(VIB-KU Leuven)의 바트 드스트로퍼(Bart De Strooper) 교수팀이 생물학 저널 ‘셀(Cell)’을 통해 그동안 비밀에 싸였던 아밀로이드 플라크와 알츠하이머병의 관계성을 밝혔다. 100여년이 지나서야 플라크와 알츠하이머 발병 과정의 비밀을 푼 것이다.
연구팀은 플라크 부근의 뇌세포에서 일어나는 분자 변화를 자세히 살피고, 플라크에 복잡한 반응을 일으키는 뇌의 여러 세포 유형이 어떻게 협력하고 작용하는지 연구했다. 그 결과 베타 아밀로이드 플라크가 뇌 신경조직에 쌓이게 되면 주변의 신경교세포에 직접 영향을 미쳐, 유전자의 다세포 발현을 동시에 유도한다는 사실을 알게 되었다.
연구팀은 아밀로이드 플라크 부근의 전사체(세포 또는 조직에서 발현된 RNA의 총합) 변화에 초점을 맞췄다. 생쥐의 수백 개 미세한 뇌 신경조직 영역에서 플라크에 의해 유발된 전체 유전체(게놈)의 전사체 변화를 자세하게 분석했다. 그러는 과정에서 베타 아밀로이드 침적에 아주 민감하게 반응하는 2개의 신경교세포 유전자가 동시에 발현하는 이른바 ‘동시 발현 유전자 네트워크(망)’를 생쥐 모델에서 확인했다.
동시 발현 유전자 네트워크는 베타 아밀로이드의 침적 양이 증가함에 따라 나타났다. 플라크에 의해 유도된 57개 이상의 유전자가 동시에 발현하는 반응을 보였는데, 이들 유전자는 주로 2가지 유형의 신경교세포, 즉 성상교세포(astroglia)와 소교세포(microglia)에서 발현되었다. 플라크가 없는 경우에는 성상교세포와 소교세포가 동시에 공동으로 발현되지 않았다.
신경교세포(glia cell)는 중추신경계와 말초신경계에서 신경세포(뉴런) 사이의 상호작용을 매개하고, 뇌 신경조직을 유지하는 세포다. 성상교세포는 뇌에서 신경세포의 기능을 돕고, 소교세포는 뇌 조직 안에 변성된 세포나 이물질 등을 없애는 역할을 하는 뇌세포다. 사람의 뇌에는 1000억개가 넘는 신경세포들이 신경교세포와 어우러져 질서정연한 배열을 하고 있다.
한편 독일 본대학 신경퇴행질환센터의 미하엘 헤네카 박사는 뇌세포의 독성 단백질인 베타 아밀로이드 플라크가 발생하면 이에 대한 반응으로 소교세포가 연결 단백질 입자(ASC speck)들을 방출하고 ASC 입자들이 베타 아밀로이드에 달라붙어 베타 아밀로이드 플라크 형성을 촉진한다는 연구결과를 ‘사이언스데일리’에 발표한 바 있다.
플라크, 치매 병리 촉진하는 매개체 역할
또 드스트로퍼 교수팀은 다른 유형의 세포, 즉 희소돌기아교세포(oligodendrocytes)에 의해 발현되는 두 번째 네트워크에서 흥미로운 변화를 발견했다. 희소돌기아교세포의 유전자 네트워크는 약한 아밀로이드 스트레스에서 활성화되었지만 아밀로이드 침적 양이 증가하면 거의 발현되지 않았다. 성상교세포·소교세포의 유전자와는 반대되는 현상이다. 이처럼 베타 아밀로이드의 침적 양에 따라 밀접하게 관련되어 움직이는 이들 유전자의 발현 패턴은 대부분 인간의 뇌 조직 샘플 실험에서도 비슷하게 나타났다.
그동안 많은 과학자는 아밀로이드 플라크가 알츠하이머병과 관련해 ‘단순한 방관자’라는 연구를 제시했다. 하지만 이번 연구는 아밀로이드 플라크가 오히려 치매 병리의 진행을 적극적으로 촉진하는 매개체 역할을 한다는 사실을 보여주는 것이라고 드스트로퍼는 말한다. 아밀로이드 플라크가 뇌 신경조직 주변의 신경교세포에 대해 강력한 유전자 협응 반응을 유도한다는 것이다.
하지만 아밀로이드 플라크를 제거할 경우 이 같은 세포 과정이 반전될지는 아직 불확실하다는 게 드스트로퍼 교수의 설명이다. 아밀로이드 플라크를 치료하기 위해 현재 개발 중인 항체 치료제가 플라크와 결합한다 해도 신경교세포 유전자의 동시 발현 반응까지 조절할 수 있을지는 가늠할 수 없다는 것. 그 여부를 알기 위해 연구팀은 더 많은 연구를 이어나갈 계획이다.
알츠하이머병은 뚜렷한 증상이 나타난 상태에선 치료하기 어렵다. 그래서 요즘엔 아밀로이드 단백질이 쌓이기 시작하는 초기에 치료적 개입을 해야 한다는 인식이 확산하고 있다. 아밀로이드 침적이 시작될 때 관여하는 유전자를 표적으로 해법을 찾으면 알츠하이머를 예방할 수도 있다는 게 이번 연구의 핵심이다. 성상교세포·소교세포·희소돌기아교세포의 병리적 작용을 확인한 드스트로퍼 교수팀의 연구가 새로운 치료법 개발의 기회로 이어지기를 희망한다.
