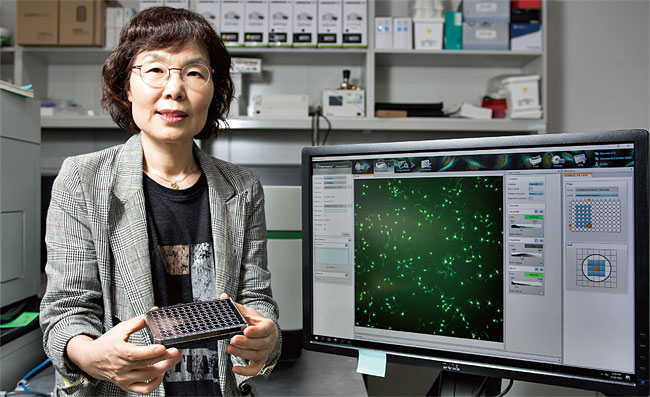
배애님 KIST(한국과학기술연구원) 박사는 약을 만드는 화학자로, 그중에서도 알츠하이머 치료물질 연구자다. 지난 8월 28일 서울 홍릉의 KIST에서 만난 배 박사는 “아밀로이드 베타를 타깃으로 한 알츠하이머 치료 약물 개발이 기대를 모았으나 잇달아 실패했다. 새로운 타깃을 겨냥한 치료제 개발이 필요하다”라고 말했다. 알츠하이머 치료제가 곧 나온다는 소문이 한때 무성했지만 당장은 어렵다는 말이었다. 배 박사는 “알츠하이머 연구는 이제 타우 단백질 공략으로 가 있다”고 강조했다.
배 박사에 따르면, 학계의 알츠하이머 연구는 타우 단백질을 타깃으로 한 치료제 개발에 많은 관심을 갖고 있다. 환자의 인지기능 저하와 타우 단백질 덩어리(tangle) 형성이 높은 상관관계를 보이기 때문이다. 그는 “요즘 알츠하이머 관련 학회에 가면 70% 이상이 타우 단백질 이야기를 한다”라고 말했다. 현재 시판 중인 알츠하이머 치료제가 5개 있지만 이 약들은 근원적인 치료제는 아니며 증상 완화제다.
아밀로이드 베타 타깃 약은 대부분 실패
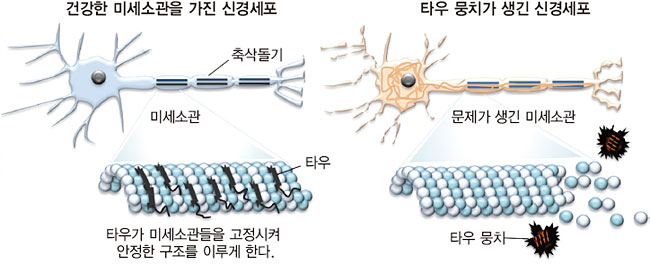
타우 단백질은 뇌신경세포의 ‘액손(axon·축삭돌기)’ 안에 들어 있다. 액손은 뇌신경세포의 세포질에서 뻗어나와 있으며, 액손 끝에는 시냅스가 있다. 이 시냅스 부위에서 한 뇌신경세포는 다른 뇌신경세포의 시냅스와 만난다. 배 박사가 보여주는 이미지를 보니 액손은 원통형 막대기이고, 그 안에는 구조단백질 미세소관(Microtubule)이 들어 있다.<60쪽 이미지 참조> 구조단백질이란 구조를 유지하게 하는 단백질이다. 미세소관은 튜브 모양이고, 작은 구슬들이 튜브의 구조를 이루고 있다. 이 구슬들을 고정시켜 흩어지지 않게 해서 미세소관이 구조를 갖도록 하는 게 타우 단백질이다.
배 박사는 “그런데 타우 단백질이 인산화가 되어 변형이 일어나면, 미세소관에서 떨어져나간다. 미세소관의 구조가 무너지고 액손이 파괴된다. 액손이 파괴되면 뇌신경세포가 죽는다”라고 말했다. 뇌신경세포가 죽으면 사람의 인지기능이 떨어지고, 알츠하이머 단계로 넘어갈 수 있다는 것이다.
그러면 아밀로이드 베타는 무엇일까? 알츠하이머 발병은 아밀로이드 베타 단백질 때문이라는 얘기를 많이 들었다. 아밀로이드 베타가 뇌에 쌓여 플라크를 이루면 그 플라크가 액손 주변을 둘러싸게 되고 그로 인해 액손이 약해지며 최종적으로 뇌신경세포가 죽는다고 한다. 배 박사는 “타우 단백질은 액손 안에 있고, 아밀로이드 베타는 액손 밖에서 문제를 일으킨다”라고 설명했다.
아밀로이드 베타 연구는 어떻게 실패했을까? 배 박사에 따르면, 거대 제약사(Big Pharm)가 개발하던 약은 대부분 실패했다. 배 박사가 아밀로이드 베타 단백질을 타깃으로 한 알츠하이머 치료제 개발 자료를 화면에 띄우고 보여줬다. 간테네루맙(Gantenerumab), 크레네주맙(Crenezumab), 아두카누맙(Aducanumab)과 같은 낯선 물질 이름들이 보였다. 아밀로이드 베타 단백질을 제거하는 물질이다. 이 물질들은 혈액 속의 아밀로이드 베타 단백질을 잡아먹는다. 아밀로이드 베타 단백질과 결합하는 방식으로 제거한다.
동물실험을 해보니 약효가 있었다. 실험은 주로 쥐를 대상으로 했다. 유전자변형을 통해 APP/PS1이라는, 아밀로이드 베타가 뇌신경세포에 많이 생겨나는 쥐를 만들었다. 그리고 항체물질을 투여하자 아밀로이드 베타가 현저히 사라졌다. 이후 쥐를 대상으로 행동실험을 했다. 약물치료를 받은 쥐는 인지기능과 기억력이 개선됐다.
조기진단도 과제
동물실험을 성공적으로 마치고 사람 대상 임상시험에 들어갔다. 임상시험은 1상, 2상, 3상으로 진행된다. 임상 1상은 건강하고 젊은 연령자를 대상으로 하며 부작용이 있는지를 시험한다. 2상부터는 약효 실험인데 수백 명의 환자를 대상으로 하며, 3상은 수천 명에 대해 시험한다. 배 박사는 “약으로 가장 전망이 좋았던 게 아두카누맙이다. 미국 생명공학업체 바이오젠이 개발했다. 임상 3상까지 진행했으나 의미 있는 약효가 나오지 않았다. 결국 지난해 임상시험 실패를 선언했다. 목표를 달성하지 못했다”라고 말했다.
아밀로이드 베타 단백질을 제거하는 다른 물질도 대부분 임상에서 실패했다. 바이오젠은 올해 들어 작년까지의 임상시험 결과를 다시 분석한 후 추가 임상시험을 진행하여 새로운 발표를 내놓았는데 ‘초기 환자를 대상으로 약물을 고용량 투여한 경우에 효과가 있었다’고 했다. 배 박사는 “미국 식약청(FDA)의 승인이 날 것 같다. 현재 해당 물질이 FDA에 사전등록(pre-registered)되어 있다”라고 말했다.
문제는 알츠하이머는 조기진단이 어렵다는 것이다. 바이오젠이 약을 내놓아 초기 환자를 대상으로 치료할 수 있다고 해도, 초기에 알츠하이머 진단을 못 한다면 소용이 없다. 아밀로이드 베타가 뇌에 쌓이는 초기 단계에서는 인지 및 기억력 저하 증상이 나타나지 않는다. 그러니 초기 단계에서 병원에 찾아올 사람이 없다. 따라서 초기에 인지기능 저하가 일어나지 않았어도 조기진단할 수 있는 기술 개발이 필요하다.
배 박사가 그래프 하나를 보여줬다. 아밀로이드 베타와 타우 단백질이 뇌 신경세포에 쌓이는 정도와 사람의 인지기능 저하 간의 상관관계를 보여주는 도표다. 알츠하이머 환자의 뇌 속에 가장 먼저 쌓이는 건 아밀로이드 베타 단백질이다. 가벼운 인지장애(MCI·Mild cognitive impairment) 단계에서도 아밀로이드는 이미 뇌 속에 절어 있다. 타우 단백질은 쌓이는 속도가 느리다. 가벼운 인지장애 단계에는 한창 쌓여가는 상태다. 그래프를 보면 타우 단백질이 쌓이는 정도와 인지기능 저하 간의 상관관계가 더 의미 있어 보인다. 배 박사는 “아밀로이드 베타가 많이 생기면 타우도 생긴다”라고 말했다.
알츠하이머 환자는 고령자에게 압도적으로 나타난다. 고령자는 알츠하이머 병에 취약하다. 그러면 인지기능 저하가 나타나기 전이라도 병원에 찾아가서 조기진단을 받을 방법은 없을까? 배 박사는 “현재로서는 없다”라고 했다. 다만 과학자들이 그 방법을 현재 연구하고 있다고 한다. 치매 단백질과 같은 바이오 마커를 찾아내는 방법을 찾고 있다는 것이다.
PET 뇌 촬영 결과와 혈액 샘플 비교
배 박사가 이끄는 KIST 치매DTC융합연구단은 조기진단과 치료제 개발에 일정한 성과를 내고 있다. 배 박사에 따르면 조기진단법으로는 유전자 진단, 혈액 진단, PET 뇌 촬영이 있다. APOE-ε4 유전자를 갖고 있으면 알츠하이머에 걸릴 확률이 95%이다. 유전자 검사는 누구라도 해볼 수 있으니 관련 시설의 도움을 받으면 유전자 보유 여부를 확인할 수 있다. 배 박사가 이끄는 사업단에 참여한 서울삼성병원(서상원 신경과 교수)은 PET 뇌 촬영을 한다. 찾아오는 알츠하이머 환자를 대상으로 아밀로이드 베타 PET 촬영과 타우 PET 사진을 찍고 환자의 혈액 샘플을 채취하고 있다. 확보한 PET 사진과 혈액 샘플을 비교하는 건 KIST(이수현 박사·뇌과학연구소)가 맡아 하고 있다. 혈액 샘플 내에 타우 단백질은 극히 소량 존재하는데 이수현 박사는 피코그램 정도의 극미량 단백질을 검출하는 센서를 개발했다. 이 모든 건 지금도 진행형이다. 혈액 샘플과 PET 사진으로 확인한 타우 단백질의 쌓인 정도를 비교해서 의미 있는 상관관계가 있는지를 확인하는 중이다. 상관관계가 높은 걸로 나오면 앞으로는 간단한 혈액검사만으로 알츠하이머가 진행 중인지 확인할 수 있을 것이다. 배 박사는 “타우 단백질의 PET 촬영이 승인되지 않았다. 연구용 임상 촬영만 승인되어 있는 상태”라고 말했다.
아밀로이드 베타 단백질을 겨냥한 치료제 개발이 실패하자, 타우 단백질을 표적으로 한 연구도 활발하다. 싱가포르 업체 타우알엑스(TauRx) 제약이 앞서 있다. 싱가포르 업체가 내놓은 LMTM은 현재 임상 3상 시험을 마쳤다. 배 박사는 “LMTM은 실패했었다. 전체적으로는 약효에 있어 통계적인 의미가 없었다. 그런데 또다시 임상을 진행하고 있다. 자료를 재분석해 보니, 의미 있는 환자군이 있었다는 것이다. 아리셉트 등 기존의 치매치료제를 사용한 환자에게는 효과가 없었으나, 그렇지 않은 환자에게는 LMTM이 효과가 있다는 것이다”라고 말했다.
타우 타깃물질 개발해 동아ST에 기술이전
배 박사 역시 타우 단백질을 겨냥한 치매치료제 후보물질을 개발해 지난해 동아ST에 기술이전을 한 바 있다. 동아ST의 옛 이름은 동아제약이고, 사업단은 선급금으로 10억원을 받았다. 현재 그가 단장으로 있는 ‘치매DTC융합연구단’은 국가과학기술연구회의 사업이다. 국가과학기술연구회는 정부출연연구소 25개를 관할하는 상부 조직이다. 이 조직이 치료 관련 연구 사업을 범 정부출연연구소 차원에서 진행하고 있고, 이를 실행하는 조직이 ‘치매DTC융합연구단’이다. ‘치매DTC융합연구단’ 안에 들어 있는 DTC는 Diagonosis(진단)·Treatment(치료)·Care(돌봄)란 영어단어의 첫 글자에서 따와 만들었다. 연 100억원을 쓰는 사업이고, 2015년에 사업을 시작해 2021년까지 계속할 예정이다. 치매를 일찍 예측하고, 치료제를 만들어내고, 환자를 돌볼 수 있는 관련 기술을 개발하는 게 이 조직의 목표다.
이 사업단에서 배애님 박사가 개인적으로 만든 알츠하이머 치료 물질은 DTC0521이다. 타우 단백질 뭉치(tangle)와 인지기능 저하의 상관관계가 높다는 데에서 착안한 연구의 성과다. DTC0521은 현재 전(前) 임상 후보물질이다. 임상시험을 하기 위해서는 이 물질을 더 가다듬어야 한다.
“2016년쯤 DTC0100 물질을 먼저 찾아냈다. 나는 KIST에서 1988년부터 일하면서 많은 물질을 만들었다. 항생제, 조현병 치료제, 우울증, 신경병성 통증 치료 물질을 개발해왔다. 그때 만든 물질을 갖고 타우 단백질을 공략하면 효과가 있는지를 확인했다. 타우 단백질 억제 효과가 있는지를 기존에 갖고 있던 ‘라이브러리(Chemical Library)’에서 확인했다. 그리고 시중에서 팔고 있는 물질도 같이 실험했다. 그 결과, 시중에서 심근경색치료제로 쓰이고 있는 물질이 효과가 좋았다. 이름만 대면 아는 유명한 물질이다. 그 물질에 DTC0100이라는 일련 번호를 부여했다. 이 물질의 약효를 개선하는 연구를 해서 DTC0521을 만들어냈으며, 동아ST에 후보물질을 기술이전할 수 있었다.”
DTC0100 분자부터 시작해서 지금까지 배 박사가 디자인한 물질은 2000개쯤 된다. DTC0100에 조금씩 구조 변화를 줘가면서 어떤 게 효과가 더 나오는지를 확인했다. 예컨대 DTC0100 물질은 구조를 크게 세 덩어리로 나눌 수 있다. 배 박사가 화면에 물질 분자식을 띄워 보여주는데 R1, R2, R3라는 글씨가 보인다. R1, R2, R3를 각각 바꿔가면서 어떤 경우에 타우 단백질 다발을 제거하는 효과가 있는지를 본 것이다.
약효 평가 플랫폼을 구축한 건 김윤경 박사다. 김 박사는 단백질 차원 검사, 세포 차원 검사, 동물 모델 실험이라는 세 가지 단계의 플랫폼을 만들었다. ‘어세이(assay)’라는 플랫폼이다. 어세이는 96개의 구멍(well), 혹은 384개의 구멍이 있는 투명한 실험기구다.(58쪽 사진에 배 박사가 들고 있는 것이 어세이다.) 이곳에 단백질이나 세포를 넣고 효능을 테스트하는 것이다. 배애님 박사는 “우리가 가진 어세이 시스템은 타우 응집을 초기에 볼 수 있는 획기적인 시스템”이라고 말했다.
일반적으로 약물 효과 기준으로는 약효가 오래 지속되느냐, 다른 약과의 상호작용은 어떠한가 등이 있다. 뇌는 인체의 여러 기관과 다른 점이 있다. 뇌는 BBB라고 불리는 뇌혈관벽이 있으며, BBB는 외부에서 들어오는 해로운 물질로부터 뇌를 특별히 보호한다. BBB는 ‘Blood-Brain Barrier’의 줄임말이다. 그렇기에 알츠하이머 약물 개발자는 BBB를 잘 통과할 수 있는 화학물질을 만들어야 한다. 예컨대 분자량이 크면 안 된다는 것이 배 박사의 말이다. 분자량이 300 이하여야 한다. 또 물을 좋아하는지 싫어하는지 등의 성격을 고려해야 한다.
싱가포르 경쟁업체 물질보다 약효 좋아
배 박사가 개발한 DTC0521 물질은 약효가 좋은 것으로 확인됐다. 배 박사가 타우 단백질을 겨냥한 자신의 물질과, 다른 업체가 만든 약물의 효능을 비교한 걸 보여줬다. 타우 단백질이 응집하는 걸 막는 물질로는 싱가포르 업체 타우알엑스가 내놓은 두 가지가 있다. 메틸렌블루와 LMTM이다.
배 박사가 보여준 비교 자료를 보면 정상세포를 촬영한 이미지는 검은색이다. 타우 단백질이 발현하도록 유전공학적으로 설계해서 만든 세포는 온통 녹색 형광빛이다. 녹색 형광이 타우 단백질을 표시한다. 싱가포르 업체가 개발한 치료약물을 투여한 뒤 찍은 세포 사진을 보니 녹색 형광이 많이 줄어 있다. 녹색은 여전히 보이나 검은색이 압도적이다. 그런데 타우알엑스의 물질 두 가지를 배 박사가 만든 DTC0100, DTC0521을 투여한 세포 사진과 비교해 보니 싱가포르 업체의 치료제보다 배 박사가 찾아낸 물질이 타우 단백질을 훨씬 더 많이 제거한 걸로 보인다. 배 박사가 치료한 세포는 거의 검은색이다. DTC0100은 약간 녹색 형광이 보이나, 이를 갖고 최적화해서 만든 후보물질 DTC0521을 투여한 세포를 촬영한 이미지는 검은빛이다. 녹색 형광이 보이지 않는다.
배 박사는 “독성 평가에서도 DTC0521이 훨씬 더 우수한 걸로 나왔다. 싱가포르 업체가 개발한 두 물질은 세포를 많이 죽이는 반면, 내가 찾아낸 물질은 독성이 매우 낮다”라고 말했다.
지난해 12월 동아ST에 치매치료제를 판매할 때 이미 10억원을 받았지만 앞으로 프로젝트가 진행되면 53억원까지 받을 수 있다고 한다. 배 박사는 “알다시피 약이 될 수 있는 후보물질은 많아도, 약으로까지 만들어지는 경우는 매우 적다. 타우 표적 치매치료제가 3상을 통과해 약으로 나오기를 바란다. 동아ST는 임상 1상까지는 진행할 것으로 예상되고, 거기에서 약효가 있는 걸로 나오면 임상 2상 이후는 다국적 제약업체에 매각을 추진할 전망이다. 임상 2상부터는 비용이 막대하게 들어가기 때문이다”라고 말했다.
배애님 박사는 ‘치매DTC융합연구단’ 사업을 이끌기 전에는 KIST 내부 조직인 ‘뇌과학연구소 뇌의약연구단’ 리더였다. 2009년부터 뇌의약연구단 단장으로 일했다. 뇌질환 관련 치료물질 개발 전문가인 그가 KIST에서 지난 32년간 연구해온 뇌질환을 보면 조현병, 우울증, 신경병성 통증, 다발성경화증, 그리고 현재 연구하고 있는 치매 치료물질 등이다.
그는 덕성여대 화학과(1981학번)를 졸업했다. 약을 만들고 싶어 약대를 가려고 했으나, 대학 1학년 때 학점 관리를 소홀히 했다가 화학과로 진로가 바뀌었다. 화학과에 오니 약대에서 하는 일 중의 하나인 약을 만드는 화학, 즉 의약화학이 있었다. 그래서 약을 만드는 화학자가 되었다. 카이스트에서 석사(1986~1988)를 하고 KIST에 들어갔다. 그리고 KIST에서 일하면서 1993년부터 고려대 정봉영 교수의 지도를 받아 박사 공부를 했다. 학위는 1997년 받았다. 박사학위는 유기화학 방법론으로 했다.
