
윤태영 서울대 생명과학부 교수는 사이언스에 논문을 여러 편 썼다. 사이언스는 네이처와 함께 당대 최고의 과학학술지다. 그간 취재한 과학자 중에서 현택환 서울대 화학생명공학부 교수를 빼면 사이언스나 네이처에 세 편 이상의 논문을 보고한 사람이 있었나 싶다. 윤 교수는 40대 중반이다. 앞으로도 시간이 많다.
윤 교수가 사이언스에 논문을 보고한 건 2010년, 2015년, 2019년이다. 스승이 있었던 박사 학생 시절이나 박사후연구원 때 쓴 게 아니고, 연구자로 혼자 선 뒤의 연구들이다. 그는 2007년 카이스트 교수가 되었으니, 2010년과 2015년 사이언스 논문은 카이스트에서 썼다. 그리고 2019년 논문은 2017년 서울대에 와서 보고한 것이다. 지난 3월 4일 긴 겨울 끝에 봄이 느껴지는 날, 서울대 유전공학연구소 2층으로 윤 교수를 찾아갔다.
윤 교수는 ‘연구 모토’ 이야기를 먼저 했다. 서울대 자연대학이 카오스재단과 같이 만든 동영상이 있다. 의대 진학 광풍에 피해를 본 자연대학 홍보를 위해 제작한 것이다. 윤 교수는 그때 제작진으로부터 연구 모토가 무엇이냐는 질문을 받았다. 그는 그때를 떠올리면서 이런 말을 했다.
“좋은 질문 갖고 있어야 좋은 연구자”
“어떤 질문을 갖고 있느냐가 연구자 수준을 보여준다. 연구자는 좋은 질문과 그 질문을 해결할 기술을 갖고 있어야 한다. 학문적으로, 기술적으로 준비된 사람이 주변에 많다. 그런데 중요한, 좋은 질문을 갖질 못해서 그분들의 연구가 상대적으로 인용이 덜 된다. 세계적 대가가 한국에 많지 않은 건 그래서가 아닐까 싶다. 대가와 잘하는 사람과의 차이는 핵심적 질문을 갖고 있느냐 없느냐라고 점점 더 느껴진다.” 그러면서 윤 교수는 “나만의 질문을 찾아보려고 열심히 해왔다. 지금은 작지만 내가 할 수 있는 질문을 찾아가고 있는 것 같다”라고 했다.
2010년과 2015년 사이언스 논문은 윤 교수가 박사후연구원으로 몸담았던 미국 일리노이대학(어바나샴페인) 하택집 교수 랩(Lab)에서 시작했던 주제였다. 그는 서울대 전기공학과 94학번. 전기공학과 대학원에서 이신두 교수의 지도를 받아 2004년 공학박사가 되었다. 그리고 이듬해인 2005년 하택집 교수에게 생물물리를 배우러 갔다. 윤 교수는 “하 교수님은 한국인으로서는 생물물리 분야에서 우뚝 선 분이다. 나는 하 교수로부터 생물물리를 배웠다”라고 했다. 그는 2005년 여름부터 2007년 10월까지 그곳에서 연구했다. 하 교수는 지금은 존스홉킨스대학에 있다. 윤 교수에 따르면, 하 교수 브랜드는 ‘단분자 프렛(Single Molecule Fluorescence Resonance Energy Transfer)’ 분광학 기술이다. “하 교수님이 기술적인 중요한 문제를 푼 것이며, 이걸 갖고 나는 SNARE단백질이라는 걸 연구했다”라고 윤 교수는 설명했다.
생물학에 도전한 공학박사
2019년 사이언스 논문은 박사후연구원 시절 스승의 영향권에서 벗어나 자신만의 문제를 발견한 연구다. 윤 교수는 “나도 나만의 질문이라든지 중요한 기술과 같은 뭔가를 뚫어주는 게 있으면 좋겠다고 생각해 왔다. 2019년에 한 건 그런 결과다. ‘자기 집게(magnetic tweezer)’ 기술이 있다. 프랑스 그룹이 만든 것인데, 우리 그룹이 이걸 고도화시켰다. 그리고 이걸 갖고 우리의 문제를 풀었다”라고 말했다. 2019년 사이언스 논문 제목은 ‘나선 막단백질이 접히는 경로를 보다(Watching helical membrane proteins fold reveals a common N-to-C-terminal folding pathway)’이다. 논문 제목을 봐서는 연구 내용을 알기 힘들다. 그가 설명을 해줬다.
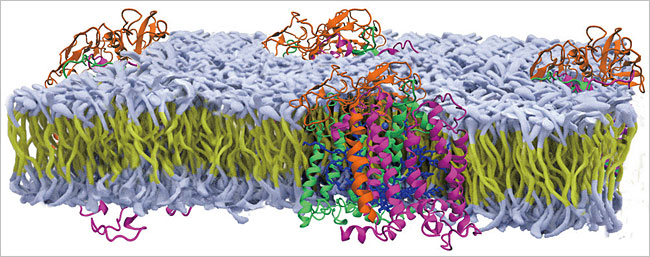
윤 교수에 따르면 세포는 막으로 둘러싸여 있다. 세포막의 안쪽과 바깥쪽 부분은 물을 좋아하는, 즉 친수성 단백질이 자리 잡고 있다. 친수성 단백질들 사이에는 물을 싫어하는 지질분자들로 이루어진 세포막이 존재한다. 안에서부터 밖으로 보면 친수성단백질, 소수성단백질, 친수성단백질 순서로 되어 있다. 윤 교수는 “지질분자들이 세포막을 이루는 모양은 올챙이들이 스크럼을 짜고 있는 것과 같다”라고 말했다. 세포막에는 많은 단백질이 붙어 있거나 박혀 있다. 세포막에 박혀 있으면서 세포 안과 밖을 연결하는 안테나 역할을 한다. 이들을 막단백질(membrane protein)이라고 한다.
윤 교수는 막단백질의 중요성에 대해 이렇게 설명했다. “전체 의약품의 50%는 막단백질을 공략한 거다. 항체 신약은 모두 막단백질을 연구해서 나온다. 코로나 바이러스도 인체 세포에 막단백질을 공략해서 침투한다. 이걸 못하게 하면 약이 된다. 코로나19 바이러스의 변이가 나왔고, 전염성이 몇십 퍼센트 강해졌다고 하는데 이 말은 막단백질을 통해 세포 안으로 기존 바이러스보다 변종이 몇십 퍼센트나 잘 들어간다는 것이다.”
의약품 50%는 막단백질 공략한 것
그런데 막단백질 구조가 어떻게 만들어지는지가 잘 알려져 있지 않다. 막단백질은 세포 안에서 만들어지며, 고유한 모양이 나오게 잘 접혀야 한다. 학자들은 그 매듭이 어떻게 접히는지도 모르고 있다. 윤 교수는 막단백질이 어떻게 풀리는지 이전에 연구해 보고한 바 있다. 단백질은 풀리는 것보다 어떻게 접히는지를 알아내는 게 중요하다. 접혀야 기능이 나오기 때문이다. 이 막단백질 접힘 연구가 2019년 사이언스 논문이다.
단백질은 아미노산이 기본재료다. 아미노산을 하나씩 연결시켜 사슬 모양을 이룬 게 단백질이다. 이때 단백질에 따라 아미노산의 수는 다르다. 그리고 아미노산이 모여 만든 단백질은 아미노산들의 물리적 특징에 따라 독특한 모양으로 접힌다. 단백질은 독특한 모양을 가지면서 고유의 기능을 얻게 된다. 윤 교수는 “매듭을 푸는 건 일반적으로 쉽다. 하지만 예쁘게 접는 건 기술이다. 어떻게 접히는지 알아내는 방법을 우리가 처음 알아냈다. 이게 2019년 사이언스 논문이고, 그리고 어제(3월 3일) 그 후속 논문을 이번에는 최상위 학술지에 보냈다”라고 말했다. 그는 “논문 심사 결과는 나오지 않았지만, 우리가 관찰한 거에 대해 뿌듯하게 생각하고 있다”라며 만족감을 드러냈다.
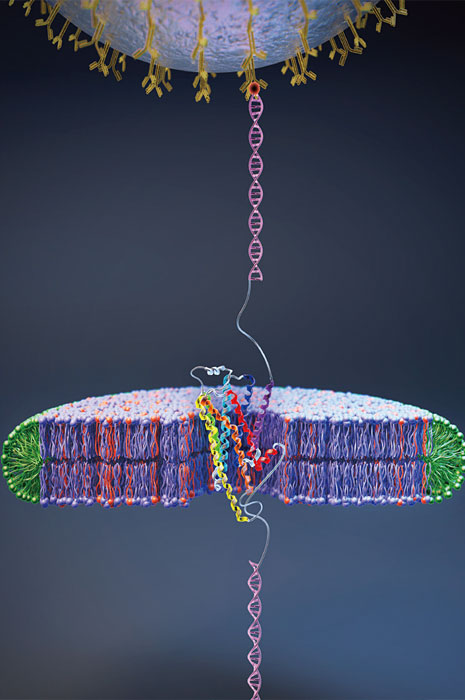
그가 그림을 보여주는데 앞에서 잠깐 언급한 ‘자기 집게’다. 광학현미경이 있고, 샘플은 현미경으로 볼 수 있게 놓여 있다. 샘플은 막단백질이다. 2019년에 연구한 막단백질은 인간 세포에 있는 GPCR단백질로서, 후각과 미각을 감지한다. 가령 GPCR은 혀의 미뢰 껍질에 있어 맛을 느끼면 그 신호를 세포 안으로 보내 우리가 맛을 감지하게 한다.
그는 GPCR단백질 하나를 자석으로 잡아당겨 펴놓았다. 실오라기 하나가 일자로 완전히 펴진 상태에서 2019년 연구를 시작했다. GPCR단백질 하나를 어떻게 풀어서 얽힌 단백질 실을 고르게 폈느냐? 이 기술은 2015년에 터득했고, 학술지 ‘네이처 케미컬 바이올로지’에 내용을 보고했다. 요령은 이렇다.
자석으로 단백질 매듭을 풀다
단백질의 한쪽은 바닥에 있는 물질 표면에 붙여 고정시켜 놓았다. 그리고 다른 한쪽에는 자성(magnetic) 입자를 달아놓았다. 수 마이크로미터 크기의 입자다. 자성 입자의 위쪽에는 자석이 있다. 자석을 위아래로 움직이면 자성 입자가 자석에 끌려 오르내릴 거다. 이 자석의 힘으로 GPCR단백질을 펴놓았다. 이게 ‘자기 집게’라고 불리는 기술이고, 실험을 한 GPCR단백질 길이는 수 나노미터~50나노미터 크기다.
윤 교수 설명을 들어본다. “자석의 힘이 강해지면 단백질 매듭이 풀린다. 힘을 가하면 단백질이 접힌 채 버티다가 어느 순간 툭툭 하고 풀린다. (그래프를 보여주며) 이 지점에서 그래프의 수직 위치가 치솟는 걸 볼 수 있다. 단백질 접힘이 이때 한 번 크게 풀어진 것이다. 그런 요령으로 단백질을 모두 풀었다. 22피코뉴턴의 힘을 걸어줬더니 단백질이 한 줄로 다 펴졌다. 이게 2015년 연구다. 2019년 사이언스 논문은 그 반대 과정, 즉 접힘을 본 것이다. 단백질이 완전히 일자로 풀린 상태에서 이번에는 자석을 약하게 한다. 5피코뉴턴으로 자석의 힘을 낮췄다. 그리고 모니터링을 했다. 풀어졌던 단백질이 다시 접히려고 했다. 접힐 때마다 자석이 위에서 아래로 내려오게 된다. 이걸 추적하니, 자성 입자의 위치가 오르락내리락했다. 자석의 힘이 약한 상황에서 단백질이 자기력을 이겨내고 다시 접혀나간다. 재밌던 건 계단 내려오듯이 툭툭툭툭 한 번에 내려오는 게 아니었다. 내려오다가 다시 올라가고, 올라가다가 다시 내려오는 식으로 단백질이 몸부림을 쳤다. 단백질은 접히려고 하는데, 때로 자석의 힘이 이긴 것이다. 이게 연구에 좋았던 건, GPCR단백질이 한 번에 접혔다면 접힘을 관찰할 순간이 한 번밖에 없었을 것이다. 그런데 여러 번에 걸쳐 풀리고 접히는 것을 반복하다 보니 관찰할 기회가 많았다. GPCR단백질의 경우 중간상이 모두 4개였다. 그리고 요즘은 빅데이터가 쌓이게 되면, 머신러닝(machin learning)을 쓸 수 있다. 머신러닝으로 단백질이 접히는 데 좀 시간이 걸린 곳, 즉 자성입자가 오르고 내리던 길목이 어디인지를 밝혀낼 수 있었다. 머신러닝으로 ‘아, 여기가 길목이네’ 하는 걸 알아낼 수 있었다. KTX열차라면, 서울에서 시작해서 정차하는 대전, 부산역이 있는 거다. 또 변신 로봇이라면, 중간에 변신을 위해 오래 머무르는 상태라고 할 수 있다. 단백질을 푸는 걸 보인 연구가 2015년 연구라면, 4년간 연구해서 단백질이 접히는 걸 세계 최초로 본 게 2019년 사이언스 연구다.”
단백질을 풀어보였던 2015년 ‘네이처 케미컬 바이올로지’에 보고한 연구의 핵심 아이디어는 무엇이었을까? 윤 교수는 “단백질과 자석의 줄다리기를 본 것이다. 그때도 단백질이 한 번에 풀리지 않았다. 자석의 위치를 약한 곳에 고정하고 자석과 단백질이 줄다리기를 하도록 시켰다. 여러 단계에 걸쳐 툭툭 하면서 풀렸고, 그로 인해 분석하기도 쉬웠다. 2019년 사이언스 연구가 인간 세포의 중요한 막단백질인 GPCR을 대상으로 했다면, 2015년 ‘네이처 케미컬 바이올로지’ 연구는 대장균의 막단백질을 갖고 했다.
포도당 수송체인 GLUT3 최신 연구
윤 교수는 “그리고 어제 최상위 저널에 보낸 연구는 포도당 수송체인 GLUT3를 갖고 했다. 내부적으로는 상당히 만족하고 있다”라고 말했다. GLUT3는 글루코스(GLU) 트랜스포터(T)의 약자이고, GLUT3번은 뇌에서 많이 사용된다. 뇌가 당을 많이 소비하기 때문이다. GLUT3는 GPCR단백질보다 구조가 복잡하다. 그는 “철학적으로 재밌는 문제가 있다”며 최신 연구 결과를 설명하기 시작했다.
“포도당, 그리고 이온도 세포막을 그냥 통과해 내부로 들어가지 못한다. 막단백질, 즉 관문단백질이 만든 구멍을 통해서 가능하다. 이를 위해 관문단백질은 세포막의 중간에 친수(親水)성 구멍을 만들어야 한다. 세포막의 안쪽은 소수성 지질분자들로 가득 차 있다. 기름 안에 물을 좋아하는 친수성 구멍을 만들기는 어렵다. GLUT3단백질을 보면 크게 두 개의 문짝이 있고, 이게 열리면 그 열린 틈을 통해 포도당이 지나간다. GLUT3단백질이 친수성 구멍을 만든 것이다.
GLUT3단백질을 먼저 폈다. 그리고 접히는 걸 보는 방식으로 연구했다. (윤 교수가 컴퓨터 모니터에 GLUT3단백질 구조를 보여준다.) 단백질의 앞쪽 절반 (노란색) 부분이 먼저 만들어지고, 뒤쪽 절반(푸른 색 부분)이 늦게 만들어졌다. 노란색 부분과 푸른색 부분이 열렸다 닫혔다 하면서 그 사이로 포도당이 지나간다. 그런데 자석의 힘을 약하게 해놓고 GLUT3단백질이 접히는 걸 보니, 이 단백질 고유의 모양이 완벽하게 나오지 않았다. 30%밖에 모양이 안 갖춰졌다. 생각만큼 원래 모양으로 돌아가려는 복원력이 강하지 않았다. 자력으로 자기구조를 다 만들지 못했다. 앞서 한 연구에서 GPCR단백질은 혼자 놔두면 원래 모양으로 완전히 돌아갔다. 그런데 친수성 구멍을 가진 단백질은 그렇게 하지 못했다. 왜 그럴까를 생각했다. 그건 ‘기능’을 위해서였다. 가운데 구멍을 뚫어야 하니, 구조를 만드는 힘이 약해진 것이다. 구조를 만드는 힘은 약해지는 대신 기능성을 얻었다. 구조안정성과 기능성을 맞바꾼 것이다. 트레이드-오프(trade-off)였다.”
그럼 구조안정성은 어떻게 얻나? GLUT3단백질에는 모양을 완성하기 위해 도우미가 있었다. 도우미 이름은 EMC(ER Membrane protein Complex·소포체 막단백질 복합체). 노란색과 파란색 부분이 각각 모양을 완성하려면, 도우미의 역할이 있을 거라고만 사람들이 생각하고 있었다. EMC가 도우미일지 모른다는 아이디어를 낸 사람은 영국 케임브리지대학의 리즈 밀러 교수다. 코로나19 대유행 이전에 독일 베를린학회에서 윤 교수는 밀러 교수를 만났다. GLUT3단백질이 접히지 않는다고 하소연했더니, 밀러 교수가 “EMC를 넣어보자”라고 제안했다. 그리고 만들어 보내줬다. EMC는 직접 단백질 10개로 된 거대복합체. 세포 안에 있는 걸 잘 추출해내야 하는데, 그런 작업을 할 수 있는 랩이 세계에 몇 곳 없다. 그래서 밀러 교수가 보내준 걸 사용했다.
한 가지 어려움이 남아 있었다. GLUT3단백질이 되려는 앞쪽 절반과 뒤쪽 절반 부분 각각은 만들어져 있으나, 두 개는 아직 못 붙은 상태였다. 링커가 둘을 연결시켜야 한다. 현재는 노란색 부분과 푸른색 부분 각각이 지질 분자, 즉 올챙이에 의해 감싸여 있다. 두 개가 붙으려면 가운데 끼어 있는 지질분자를 제거해야 한다. 최현규 박사가 연구를 하다가 특이한 지질분자를 넣어봤다. 그랬더니 갑자기 노란색 부분과 파란색 부분이 합쳐졌다. 최 박사는 현재 미국 조지아공대에서 박사후연구원으로 일한다. 윤 교수는 “2019년 사이언스 논문 연구도 최현규 박사가 주도한 것”이라고 말했다. 윤 교수는 “이런 연구 성과를 냈기에 우리가 막단백질 형성 원리에 관해서는 세계적으로 가장 앞서게 되었다. 막단백질 형성 원리, 형성 경로 규명에서는 세계 최고다”라고 말했다.
공학서 물리 거쳐 생명과학으로
막단백질 연구는 그 중요성에도 불구하고 수용성단백질에 비해 뒤처졌다. 막단백질 연구에 있어서 혁명은 2010년대 초반 저온전자현미경의 출현이다. 이걸로 막단백질의 완성된 구조를 알아내고 있다. 윤 교수는 “엄청나게 빠르게 구조가 밝혀지고 있다. 그런데 어떻게 그 구조가 만들어졌는지, 경로는 모르는 거다. 나의 그룹이 그걸 가장 앞서 알아내고 있다. 그래도 문제가 산적해 있다. 기능과 구조가 극히 조금 알려져 있으나, 그걸 갖고 어떻게 약을 만들어낼 것이냐, 대량으로 공업적으로 생산할 것이냐 하는 것도 있다. 갈 길이 멀다”라고 말했다.
막단백질 종류는 약 6000개로 추정된다. 인간 게놈 안에 있는 유전자 2만개 중 30%가 막단백질 유전자다. 어느 세포에나 있는 기본적인 막단백질도 있지만, 세포 특이적인 막단백질이 많다. 유명한 막단백질에 무엇이 있는지를 물었다. 윤 교수는 성장호르몬 수용체 단백질을 언급했다.
윤태영 교수는 당초 전기공학 박사학위를 받았다. 박사후연구원 시절부터 생물물리학을 공부했다. 그리고 이날 서울대에서 만나 물어보니 “나는 이제 생물학자라고 생각한다”라고 말했다. 그는 공학에서 물리로, 물리에서 생명과학으로 경계를 계속 넘어온 과학자였다. 변신과, 그 이후의 성공적인 성과물에 놀라지 않을 수 없었다.
