
‘실험동물 사육실(정호성 교수님)’이라고 문에 쓰여 있고, 개구리 그림이 그 옆에 붙어 있다. 지난 3월 25일 연세대 의대 정호성 교수를 따라 들어간 그의 실험실 내 사육실. 작은 방의 벽면을 따라 어항 10여개가 있다. 그 안의 개구리들은 연한 녹색 피부를 갖고 있고, 크기가 크지 않다. 정 교수가 “학명으로는 제노푸스 트로피칼리스(Xenopus tropicalis)이고, 한국어로는 아프리카 발톱 개구리”라고 설명해줬다. 암컷과 수컷은 다른 수조에 분리돼 들어 있다.
정 교수는 “개구리는 가설을 빨리 시험해볼 수 있는 모델 동물이다. 과(過)배란을 유도하는 주사를 놓으면 암컷이 배란을 한다. 그러면 수컷에서 정소를 꺼내고 접시에서 수정한다. 많은 개구리의 알을 동시에 수정시킬 수 있다”라고 설명했다. 사진을 찍고 싶었으나, 윤리규정상 실험동물 사진을 찍지 못한다. 개구리를 실험동물로 사용하는 연구자는 처음 봤다.
실험실의 아프리카 발톱 개구리들
정 교수는 “나는 신경생물학자이고, 그중에서도 신경발생생물학을 연구한다”라고 말했다. 그는 의대 학생들 강의를 위해 만든 슬라이드 자료를 연구실 컴퓨터 화면에 띄워 보여주면서 연구를 설명했다.
정 교수는 “신경계에만 있는 세포가 있다. 뉴런(신경세포)이다. 뉴런들은 시냅스(synapse)를 통해 서로 연결되어 있다는 점에서 인체의 다른 세포들과 다르다. 시냅스는 신호를 주고받는 데 특화되어 있는 세포 간 접합이다”라고 말했다. 뉴런은 세포 몸통인 세포체를 가지고 있는 건 다른 세포와 같다. 하지만 뉴런 간에 신호를 주고받기 위해 긴 팔에 해당하는 축삭돌기와 수상돌기라는 걸 갖고 있다는 점이 다르다. 축삭돌기는 신호를 다른 뉴런으로 보내는 통로이고, 수상돌기는 다른 뉴런으로부터 신호를 받는 일에 특화되어 있다. 시냅스는 주로 축삭과 수상돌기가 만나는 곳에 생긴다. 정 교수는 이 중에서도 축삭 연구자다. 축삭의 발달을 연구한다.
정 교수는 “크게 보면 축삭 길 찾기(axon guidance)가 내 연구의 주제”라고 말했다. 그는 뉴런 중에서도 시각 뉴런을 연구한다. 동물의 눈과 뇌의 시각중추는 몸이 만들어질 때, 가령 사람의 경우에는 어머니 자궁 속에서 연결된다. 눈의 망막에 있는 세포에서 축삭이 뇌 속에 있는 시각중추의 관련 세포까지 길을 찾아가면 성공적으로 루트가 완성된다. 시신경세포가 뻗은 축삭이 어떻게 뇌의 시각중추까지 찾아가는가를 알아내는 게 ‘축삭 길 찾기’ 연구다.
시신경세포는 어떻게 뇌와 연결될까
동물은 눈의 망막에 빛을 감지하는 광수용체를 갖고 있다. 광수용체는 막대세포와 원뿔세포에 들어 있고, 이들 세포는 빛 신호를 전기 신호로 바꾼다. 그리고 이 전기 신호가 시냅스를 거쳐 이웃한 뉴런에 전달되면 밝음, 어둠과 같이 중요한 정보가 생성된다. 그리고 이 정보를 망막신경절세포(RGC·Retinal Ga nglion Cell)가 받아 뇌(시각중추)로 보낸다. 이 정보는 시각정보가 눈을 떠나 RGC 축삭을 타고 뇌로 가는 것이다. RGC 축삭은 뇌의 시각중추로 길게 뻗어 있다.
정 교수가 신경발생생물학 연구를 시작한 건 2009년 영국 케임브리지대학에서다. 그는 서울대 분자생물학과(94학번)를 졸업하고 미국 노스웨스턴대학(시카고 소재)에서 2008년 박사학위를 받았다. 박사 때는 ‘신경발생생물학’을 공부한 게 아니라 ‘신경생물학’을 공부했다. 당시 지도교수는 약리학자인 리처드 밀러. 정 교수는 박사 마지막 해에 박사학위를 받으면 무슨 공부를 할까 궁리하다가 케임브리지대학 신경발생생물학자인 크리스틴 홀트(Christine Holt) 교수의 논문을 읽었다.
케임브리지 크리스틴 홀트 교수에게 배우다
그리고 대서양을 건너가 홀트 교수의 지도를 받아 신경발생생물학을 공부했고, 학술지 셀(Cell)에 2012년 눈에 띄는 연구를 내놓았다. 셀은 생명과학 분야의 가장 좋은 학술지이다. 당시 정 교수의 논문 제목은 ‘핵(核) 밖에서 일어나는, 라민 B 단백질의 국소적인 번역이 축삭의 유지 관리를 돕는다(Local Translation of Extranuclear Lamin B Promotes Axon Maintenance)’쯤 된다. 그의 연구를 이해하기 위해서는 ‘축삭 길 찾기’ 연구의 배경 지식이 좀 필요하다. 다른 게 아니라 정 교수의 은사인 홀트 교수의 지나간 연구를 보면 된다.

홀트 교수의 1980년대 초반 연구를 보자. 이미지 하나가 있다.<그림1 참조> RGC가 뇌 속으로 뻗은 축삭이 반원을 그리고 있다. 반원의 끝에는 중뇌의 시각중추가 있다. 정 교수는 “홀트 교수는 1980년대 초반, 세포 하나의 축삭이 시각중추를 찾아가는 모습을 이미지로 보여줬고, 그래서 연구가 극적이었다”라고 말했다.
홀트 교수의 1987년 연구도 보자. 논문의 핵심은 이렇다. 뇌 속으로 뻗고 있는 축삭의 끝에는 성장원추(growth cone)라는 게 있다. 성장원추가 세포체에 있는 핵과 물리적으로 분리되어 있어도 목표 지점인 뇌의 시각중추를 단독으로 찾아간다는 걸 홀트 교수는 확인했다. 요령은 이랬다. 그는 살아 있는 올챙이의 RGC 몇 개를 형광으로 표지하고 그 축삭이 시각중추를 향해 자라는 과정을 실시간으로 관찰했다. 그런데 목적지에 도달하기 이전에 세포체와 축삭의 연결을 끊어버렸다. 축삭이 세포체로부터 분리되었다는 건, 길 찾기에 필요한 단백질을 그때그때 핵으로부터 공급받을 수 없다는 걸 뜻한다. 핵은 세포체에 있기 때문이다. 그런데 놀라운 일이 일어났다. 축삭 끝의 성장원추는 목적지인 시각중추를 정확히 찾아갔다. 이는 성장원추에 독자적인 목적지 탐지 능력이 있다는 걸 뜻한다.
홀트 교수가 가졌던 그다음 단계에서의 과학적 질문은 시각중추에 도착하면 무엇이 있기에 성장원추가 목적지인 줄 알아차리는가다. 이게 2001년 연구 내용이고, 정호성 박사는 이 논문을 보고 미국에서 영국으로 홀트 교수에게 배우러 갔다. 정 교수 설명을 계속 들어본다.
축삭 내에서 일어나는 mRNA 번역
“올챙이 성장원추는 중뇌의 시각중추를 찾아갈 때 주변에 있는 특정 단백질을 교통신호등으로 삼는다. 성장원추가 특정 단백질을 인지하면 특정 신호를 축삭 내부로 전달하고, 축삭 내부에서는 그에 맞는 특정 분자가 만들어진다. 이 특정 분자가 ‘축삭 길 찾기 인자’이고, 사람들은 길 찾기 인자가 어떻게 작동하는지 알고 싶어 했다. 홀트 교수는 2001년에 ‘성장원추 회전 어세이(assay)’라는 방법을 사용했다. 피펫이라는 생명과학자가 쓰는 장비가 있다. 끝을 누르면 피펫 안에 있던 액체가 피펫 끝으로 나온다. 피펫에 특정 단백질을 넣고 1초 간격으로 나노리터라는 아주 작은 양을 접시에 쏘아준다. 접시에는 세포체로부터 잘린 RGC의 축삭이 놓여 있다. 축삭 끝에는 성장원추가 있다. 성장원추는 피펫에서 나오는 특정 단백질의 존재를 느낀다. 그 단백질의 접시 내 농도 기울기가 높아짐에 따라 그걸 회피할지, 혹은 그쪽으로 움직일지를 결정한다. 이때 mRNA(messenger RNA·전령RNA) 번역저해제(translation inhibitor)라는 화학물질을 뿌린다. 번역저해제는 mRNA가 세포(축삭) 내부에서 단백질로 번역되는 걸 막는 물질이다. 그랬더니 성장원추는 외부의 신호등들에 반응하는 능력을 잃어버렸다. mRNA가 축삭 안에서 번역되지 못하면서, 길 찾기 능력을 상실한 것이다. 이는 핵으로부터 분리되어 있어도 축삭 내에서 mRNA 번역이 일어나고 있었다는 얘기가 된다. 홀트 교수가 실험했던 올챙이의 성장원추는 핵으로부터는 잘려 있었다. 핵으로부터 mRNA 공급을 받지 못했다. 그런데 접시에 있던 성장원추는 어디에서 mRNA를 가져올 수 있었던 것인가? 답은 핵이 그때그때 보내는 게 아니라, 핵이 미리 mRNA들을 만들어 멀리 떨어진 축삭에 공급했다는 게 된다. 그리고 필요한 단백질을 그때그때 현장에서 국소적으로 mRNA를 번역, 생산, 사용하고 있었던 것이다. 결국 홀트 교수는 생명과학 용어로는 ‘국소 번역(local tranlation)’이 일어난다는 걸 증명한 셈이 되었다.”
정호성 박사후연구원의 2012년 셀 논문은 2001년 홀트 교수 연구에서 시작한다. 2001년 연구는 축삭에서 국소 번역이 일어나는 줄은 확인했으나, 번역되고 있는 mRNA가 무엇인지는 몰랐다. 그걸 알아낸 게 정호성 박사 연구다. 이때도 실험에 사용한 동물이 아프리카 발톱 개구리다.
연세대의 정 교수 방에는 개구리 인형이 몇 개 보였다. 벽에 개구리 그림도 있었다. 그는 “학생들이 실험실 마스코트와 같다고 생각하는지, 하나둘씩 갖고 왔다”라고 말했다. 사진기자가 정 교수 사진을 연구실에서 찍을 때 나는 개구리 마스코트를 정 교수와 함께 보여주고 싶었다. 그래서 딱딱한 포즈보다는 개구리로 약간 코믹한 장면을 연출하면 어떨까 해서, 그의 한쪽 어깨에 개구리 인형을 올려놓고 사진을 찍었다.

라민 B2 단백질로 시각중추 찾아가
정 교수에 따르면, 개구리가 좋은 점은 접시에서 쉽게, 그리고 수백 마리를 동시에 수정시킬 수 있고, 수정 다음 날이면 눈과 뇌가 생긴다는 점이다. 그리고 그다음 날이면 눈(RGC)과 뇌가 연결된다. 유전공학적인 개구리를 만들기도 상대적으로 손쉽다. 수정하고 2~3시간 후에 형광단백질이 들어가 있는 DNA나 RNA를 올챙이의 중추신경계가 될 부분에 넣으면 된다. 그다음 날이면 형광눈에서 축삭이 나와, 야생 올챙이 뇌의 시각중추와 연결된다. 정 교수는 “모델 쥐를 만들려면 몇 년이 걸리지만, 올챙이는 며칠이면 된다”라고 말했다.
정 교수는 2012년 셀에 보고한 연구에서 ‘라민 B2’라는 단백질이 올챙이 RGC의 축삭 끝에 있는 성장원추에서 합성되고 있다는 걸 알아냈다. 그리고 미토콘드리아라는 세포 소기관이 축삭에 많다는 걸 확인했다.
미토콘드리아는 세포 내 에너지 공장이라고 얘기된다. 정 교수는 “축삭이 하는 일이 신호전달이다. 자신이 속한 뉴런에서 다른 뉴런으로 신호를 보낸다. 신호전달에는 에너지가 많이 든다. 그래서 미토콘드리아가 축삭에 많은 듯하다”라고 말했다.
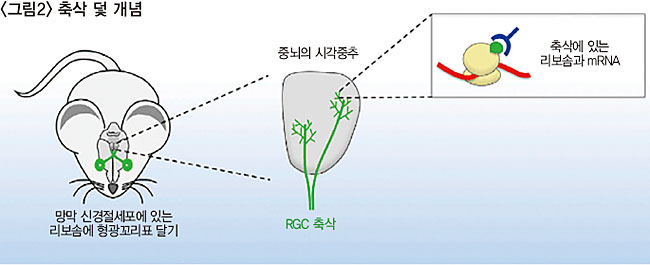
정 교수는 라민 B2 단백질이 만들어진다는 걸 어떻게 알아냈을까? 그는 ‘축삭 덫(Axon-Trap)’이라는 개념을 사용했다.<그림2 참조> ‘축삭-덫’은 축삭에서 합성되는 단백질이 무엇인지를 알아낼 수 있는 방법이다. 리보솜은 mRNA를 단백질로 번역하는 세포 내 소기관이다. 핵에서 나온 mRNA는 리보솜으로 가서 그 내부의 ‘번역’ 작업을 거쳐 단백질이 된다. 우리는 RGC 축삭 안에 mRNA가 미리 저장되어 있는 줄은 알고 있다. 이 mRNA를 단백질로 번역하는 게 축삭에 있는 리보솜이다. 리보솜이 특정 순간에 번역하고 있던 mRNA를 잡아낼 수 있다면, 그게 무엇인지 확인할 수 있다는 게 연구의 아이디어였다. ‘번역’의 순간을 정 교수는 어떻게 포착할 수 있었을까?
정 교수는 “리보솜은 거대분자다. RNA와 단백질 여러 개로 구성되어 있다. 나는 리보솜을 구성하는 단백질에 형광단백질(GFP)을 붙였다”라고 말했다. 자라나고 있는 RGC 축삭만을 꼭 집어서 분리해내는 건 불가능하다. 여러 조직이 섞여 있기 때문이다.
리보솜을 분리해내도 이게 내가 보려는 축삭 안에 있던 것인지, 뇌의 다른 세포에 들어 있던 것인지 구분할 수 없다. 그래서 정 교수는 축삭 안에 있던 리보솜만을 형광단백질로 표지하는 방법을 사용했다. 특정 순간의 리보솜은 그 순간에 번역하던 mRNA를 입에 물고 있다. 이 ‘축삭 덫’에서 mRNA를 꺼내 정체를 알아보았고, 그건 라민 B2 단백질을 암호화하는 mRNA였다.
정 교수는 케임브리지에서의 4년여 박사후연구원 생활을 마치고, 2013년 3월 연세대 교수로 부임했다. 그리고 2016년 학술지 셀에 다시 논문을 발표했다. 이때는 배양하는 올챙이가 아니라, 건강한 쥐에서 발생 중인 RGC 축삭에서 어떤 mRNA가 번역되고 있는가를 알아내고자 했다. 2012년 셀 논문이 올챙이를 대상으로 ‘축삭 덫’이라는 기술을 사용하면 단백질로 번역되고 있던 mRNA를 확인할 수 있다는 걸 보였다면, 2016년 셀 논문은 이를 살아 있는 쥐에 본격적으로 적용한 것이었다.
‘축삭 덫’ 개념 통해 mRNA의 단백질화 추적
쥐는 개구리와 눈과 뇌가 연결되는 시기도 다르다. RGC 축삭만 보면, 엄마쥐 자궁 속에 있는 새끼쥐는 태어나기 3일 전까지는 뇌의 시각중추에 거의 접근(축삭 형성기)한다. 그리고 생후 1주일이면 축삭 끝의 성장원추가 시각중추에 도착해 연결(시냅스 생성기)된다. 그리고 그다음은 시각신경계 완성기다. 정 교수는 ‘축삭 덫’ 방법으로 각 단계에서 어떤 mRNA가 언제 번역을 통해 단백질로 만들어지는지를 알아냈다. 정 교수는 “발달 단계별로 리보솜을 분리해, 리보솜이 물고 있던 mRNA의 서열을 읽었다. 그래서 mRNA에서 번역되고 있던 단백질이 무엇인지 알 수 있었다”라고 말했다.
그런데 예상치 못한 발견이 있었다. ‘국소 번역’은 RGC의 ‘축삭 길 찾기’에 중요하다고 생각하고 있었다. 시신경이 뇌와 연결되는 과정에서만 역할을 할 거라고 보았으나, 그게 아니었다. 태어난 지 6개월이 된 어른쥐에서도 시신경 축삭 말단에서 번역이 일어나고 있었다. 그게 왜 그런지는 알 수 없었다.
정 교수의 현재 연구는 2016년 셀 논문에서 출발한다. 이 연구는 축삭에 저장되어 있는 mRNA가 발생 과정에서만 필요한 게 아니라, 어른의 신경계를 유지하는 데도 필요하다는 걸 뜻했다. 정 교수는 현재 연구는 ‘축삭 발생’이 아니라 ‘축삭 생존’이라고 할 수 있다.
정 교수는 지난해 삼성미래기술육성재단이 자신들의 기초과학 연구 지원을 홍보하기 위해 내세운 한국의 알츠하이머 연구자 3명 중 한 명이다. 정 교수가 알츠하이머 연구자로 언급된 건 그의 현재 연구가 ‘축삭 생존’에 방점이 찍혀 있기 때문이다. 알츠하이머, 파킨스씨병과 같은 신경퇴행성질환은 뇌신경세포가 망가지고 결국은 죽기 때문에 발생한다. 뉴런은 독특한 게 ‘축삭’부터 망가진다. 축삭은 때로 길이가 1m까지 된다고 했는데, 긴 축삭일수록 망가지기 쉽다. 축삭이 먼저 분해되고, 시간이 지나면 세포의 중심을 이루는 세포체가 죽는다. 멀리서부터 세포가 죽어온다고 해서 이 현상을 영어로는 ‘dying-back(다잉백)’이라고 한다.
연구자들은 축삭이 죽는 경로(axon death pathway) 연구를 많이 했다. 그래서 SARM1, NMNAT2라는 두 개의 중요한 유전자를 찾아냈다. 초파리 연구자의 공로가 컸다. SARM1은 축삭의 죽음을 촉진하고, NMNAT2는 죽음을 억제하는 유전자다. 그러니 있는 SARM1 단백질은 제거하고, 없는 NMNAT2 단백질을 집어넣어 주면 병든 축삭이 죽기까지 가는 건 조절할 수 있지 않을까 생각하는 연구자들이 있다. 정 교수는 “이런 개념을 도구로 삼아, 다 자란 정상적인 축삭 말단에서 어떤 단백질이 만들어지는지, 그 단백질 생산을 막으면 축삭이 살아남지 못하는지를 연구하고 있다. 그 지식이 쌓이면 퇴행성신경질환의 극복에 도움이 되지 않을까 기대하고 있다”라고 말했다.
