
울산과학기술원(UNIST) 103동 2층 228-2호. ‘제브라피쉬 사육실’이라고 쓰여 있다. 명경재 기초과학연구원(IBS) 유전체항상성연구단 단장이 출입문을 여니, 제브라피시 어항이 100개 넘게 보인다. 제브라피시는 열대관상어. 눈으로 보는 건 처음이다. 투명한 플라스틱으로 된 작은 어항들이 철제구조물 사이에 층층이 놓여 있다. 통 하나에 수십 마리가 보인다. 물고기 길이는 3~4㎝ 정도. 그가 보여주는 어항의 겉면을 보니 종이에 ‘ATAD5’ ‘Parp1’ ‘Rtel1’과 같은 글자들이 쓰여 있다. 이 글자들은 유전자 이름으로, 이 유전자들은 DNA 수리를 전문으로 하는 단백질을 만든다.
제브라피시로 DNA 수리 단백질 만든다
DNA는 생명체의 유전정보가 담긴 유전물질. 그런데 자외선과 같은 외부의 자극에 의해 변형되고, 방사선에 의해 끊어지기도 한다. 나선을 이루는 염기(네 종류) 자리에 엉뚱한 염기가 들어갈 수도 있다. 이를 복구하지 않으면 세포가 죽거나 돌연변이를 일으킨다. 돌연변이는 암세포로 발전할 수 있어 위험하다. 명 단장은 분자생물학자이고, 세포가 핵 안의 손상된 DNA(디옥시리보핵산)를 어떻게 고치는지를 연구해왔다. 명경재 단장이 이끄는 IBS 연구단 이름이 ‘유전체항상성연구단’이다.
제브라피시 통에 이름이 써 있는 ‘ATAD5’ 유전자는 명 단장이 발견했다. ATAD5 유전자는 그가 미국 국립보건원(NIH) 산하 인간유전체연구소에 재직할 때(2002~2014)인 2004년에 찾았다. 명 단장이 키우는 제브라피시들은 DNA 유전자 중 하나가 고장나 있다. 제브라피시가 갖고 있는 단백질을 만드는 유전자는 2만6206개. 이 중 생명을 유지하는 데 필수적인 유전자를 빼고, 다른 유전자를 하나씩 제거해, 유전자 변형 물고기를 만들었다. 그런 뒤 제브라피시에서 어떤 일이 일어나는지를 보고 있다. 생물학 용어를 쓰면 ‘표현형(phenotype)’이 어떻게 달라지는지를 관찰하는 게 제브라피시 연구의 목적이다. 명 단장은 “유전자를 변형시킨 제브라피시가 100여종 된다”라고 말했다.
과학자가 연구를 위해 많이 쓰는 모델 동물은 다양하다. 생쥐, 예쁜꼬마선충, 초파리, 제브라피시, 효모(yeast) 등등이 있다. 쥐는 사람과 제일 가깝다. 사람과 같은 척추동물이면서 포유류이기 때문이다. 하지만 연구에 단점이 있다. 유전자 변형 쥐를 만드는 데 시간이 몇 년씩 걸린다. 그걸 만들어도, 연구하는 데 추가로 몇 년이 소요된다. 반면 제브라피시는 역시 척추동물이기에 사람과 비교적 가깝고, 알이 부화해서 몸의 골격이 만들어지는 데 120시간이면 충분하다. 알에 유전자 변형을 일으키더라도 그 결과를 알아내는 데 5일이면 된다. 명 단장의 ‘유전체항상성연구단’은 제브라피시 말고 예쁜꼬마선충과 쥐도 키운다. 예쁜꼬마선충은 부연구단장 중 한 사람인 앤서니 가트너 박사가 연구를 위해 사용한다. 부연구단장은 명 단장 연구단에 두 사람이 있고 모두 해외 두뇌다.
명 단장은 “제브라피시를 모델동물로 써봐야겠다는 생각은 미국 NIH에서 근무할 때 했다. 그리고 2014년 IBS의 연구단장으로 선임되었기에 한국에 와서 연구를 시작할 수 있었다. 이윤성 박사가 제브라피시 사육시설을 다 구축했다. 지금은 유전자 변형 제브라피시들을 만들어놓고 그들에게 어떤 일이 일어나는지를 보고 있다”라고 말했다.
사육실을 나와 명 단장 연구실로 돌아왔다. 그의 책상 뒤 벽에 미국 브라운대학 박사과정을 마치면서 받은 상장이 보인다. Karp1 유전자를 발견하고 받은 상이다. 명 단장은 “브라운대학에서 논문을 두 개 썼다. 그중 하나가 DNA 수리 유전자인 Karp1을 발견한 연구이고, 이건 EMBO(유럽분자생물학기구)저널에 냈다”라고 말했다. 5년간 논문을 두 개만 쓰다니… 화학자나 물리학자는 같은 기간이라면 훨씬 많은 논문을 쓰는 걸로 기억한다. 그는 “생물학 분야에서는 논문이 쉽게 나오지 않는다”라고 말했다. 인내심이 필요한 분야다.
명경재 단장은 서울대 동물학과(87학번)를 졸업하고 서울대 대학원 석사 때 DNA 손상복구 연구를 접했다. 당시 박상대 교수 실험실(세포생물학실험실)에서 공부했다. 박 교수는 DNA 손상복구 분야의 한국 내 1세대 연구자. 박사학위는 브라운대학의 에릭 헨드릭스 교수에게 가서 했다. 1999년 박사학위를 받은 뒤에는 캘리포니아대학(샌디에이고 소재 UCSD)에 있는 루드윅(Ludwig) 암연구소의 리처드 콜로드너(Kolodner) 교수에게 갔다. 그는 “콜로드너 교수는 노벨상을 상당히 아깝게 놓치신 분”이라고 말했다.
대장암 환자서 발견되는 틀린 짝 복구 유전자
2015년 노벨화학상은 DNA 보수를 연구한 세 사람에게 갔다. 명 단장은 “이들은 DNA 손상복구 메커니즘의 세 가지를 각각 알아냈다”라고 말했다. 노벨상이 주어진 DNA 보수유지 기전(mechanism) 세 가지는 염기절단복구, 핵산절단복구, 틀린 짝 복구다.
‘염기절단복구(Base Excision Repair)’는 토머스 린달(영국 프랜시스크릭연구소)이 알아냈다. 염기는 유전자 정보가 담긴 핵심적인 물질이며 A, T, G, C 네 종류가 있다. 염기가 엉뚱한 걸로 바뀌어 있으면, 수리하는 단백질은 그걸 잘라내고 올바른 염기로 바꿔 넣는다.
‘핵산절단복구(Nucleotide Excision Repair)’ 단백질은 변형 부위를 포함한 염기서열 30개를 왕창 들어내는 식으로 수리를 한다. 핵산은 염기-당(오탄당)-인산 세 가지로 된 구조다. 강한 자외선에 노출되면 그 세포의 핵에 들어 있는 DNA 이중나선의 TT에 변형이 생긴다. 핵산절단복구 기전은 아지르 산자르 미국 노스캘리포니아대학 교수가 알아냈다.
또 ‘틀린 짝 복구’는 세포분열 과정에서 DNA 염기서열이 잘못 복제될 때 일어나는 오류를 세포가 바로잡는 방법이다. DNA 이중나선을 벌리고 복제를 하는데, 염기 100만개 복제 시 염기 한 개를 잘못 복사하는 비율로 오류가 발생한다. 틀린 짝 복구 기전은 미국 듀크대학의 폴 모드리치가 알아냈다.
“그때 사람들이 관심이 있었던 게 암세포였다. 암세포를 열어보면 돌연변이가 굉장히 많다. 그전까지 사람들은 유전자 한 개 안의 염기서열에서 일어나는 돌연변이에 관심이 많았으나, 암세포의 돌연변이는 이것과는 비교도 할 수 없이 큰 스케일의 변이도 존재한다. 암세포의 경우 가령 1번 염색체의 덩어리 한 부분이 떨어져 4번 염색체에 붙는 대규모 돌연변이가 있다. 그래서 사람들은 암세포를 두 가지로 구별했다. MIN(Microsatellite Instable·현미 부수체 불안정성)종양과 CIN(Chromosome Instable·염색체 불안정성)종양이다. MIN종양은 유전자 염기서열 변형과 관련되어 있고, 루드윅 암연구소 지도교수나 2015년 노벨화학상 수상자는 모두 MIN을 연구했다. 나는 브라운대학과 박사후연구원 때 CIN을 연구했다. CIN은 염색체가 두 배로 늘어나 있기도 하고, 엉뚱한 데에 송두리째 자리가 옮겨가 있는 암종양과 관련되어 있다.”
콜로드너 교수는 빵을 부풀리거나 포도주를 발효시키는 미생물인 효모도 연구하고 있었다. 명 단장은 “효모는 연구를 위한 강력한 모델생물이다. 효모는 핵이 있고(진핵생물) 염색체를 갖고 있다. 핵을 갖고 있지 않은 박테리아보다 훨씬 뒤에 출현했다”라고 설명했다. 콜로드너 교수는 효모의 DNA 돌연변이를 염색체 수준에서 측정할 수 있는 시스템을 개발하고 있었다. 그때까지 암세포의 염색체는 어떤 유전자가 고장나서 그렇게 되는지, 특정 유전자에 돌연변이가 생긴다면 염색체 수준에서 어느 정도로 문제가 생긴 것인지를 측정할 수 있는 방법이 없었다. 명 박사는 자신이 궁금해하던 CIN 유형의 암을 효모를 갖고 테스트해 볼 수 있겠다고 생각했다. 효모의 유전자를 하나씩 망가뜨리면서 어떤 돌연변이가 염색체 수준에서 대규모로 일어나는지를 볼 수 있겠다고 기대했다. 그리고 그는 염색체 수준의 돌연변이를 효모에서 측정할 수 있는 시스템 구축에 성공했다.
UNIST의 명 단장 방의 벽에는 그가 루드윅 암연구소 시절에 쓴 논문들 이미지가 액자 속에 들어가 걸려 있었다. 셀, 네이처, 사이언스 등 최상위 과학학술지에 보고한 논문들이다. 논문 내용을 찾아봤다. 셀(Cell·2001년 2월) 논문 제목은 ‘효모의 S상 체크포인트 기능이 자발적인 염색체 재배치를 억제한다’이고, 네이처(2001년) 논문 제목은 ‘효모에서 유전체 불안정성을 억제하는 데 여러 경로가 협력한다’이다, 사이언스(2002년) 논문 제목은 ‘효모의 유전체 안정성 유지’, 20년 전 그가 30대 중반일 때 얻어냈던 빛나는 성과들이다. 효모가 분자생물학자인 그에게 준 선물이었다.
제브라피시 사육실에서 앞서 보았던 DNA 보수 유전자 중에 ATAD5 유전자가 있었다. 이 유전자도 효모에서 발견했고, 연구 결과는 이후 미국 국립보건원(NIH) 산하 인간유전체연구소에서 얻었다. 미국 국립보건원은 산하에 연구소를 28개 갖고 있는데 이 중 인간유전체연구소는 2000년대 초에 끝난 인간유전체 프로젝트를 수행한 곳으로 유명하다. 명 박사는 2002년 NIH 인간유전체연구소에 들어가 ‘유전체 불안정(Genome Instability)’ 섹션을 만들었고, 섹션 책임자로 일했다. 5년 뒤인 2009년 정년심사를 통과해 영구직 연구자가 되었고, 2014년 IBS에 연구단을 만들어 한국에 오기 전까지 그곳에서 12년을 일했다.
효모 연구가 안겨준 선물들
명 단장이 NIH 근무를 시작할 즈음 효모 커뮤니티에서 한 가지 성과가 있었다. NIH 인간유전체연구소는 사람 DNA 염기서열을 읽어내기에 앞서 1997년 효모 DNA 염기서열을 먼저 읽어냈다. 그리고 효모 유전자 하나하나를 제거한 돌연변이 효모들을 만드는 작업을 2001년에 마무리했다. 효모 유전체 안의 유전자는 6000개쯤인데 이 중 효모의 생존에 필수적인 유전자는 약 1000개다. 나머지 4000~5000개는 없어도 바로 효모가 죽지는 않는다. 효모 연구자들은 효모를 대상으로 4500개 유전자를 하나씩 없앤 돌연변이 효모 4500종류를 만들었다. 4500개의 돌연변이 효모는 분자생물학자에게 엄청난 연구 자산이 됐다. 명 단장은 샌디에이고의 루드윅 암연구소 시절 유전자 돌연변이로 인해 염색체가 깨져서 이상하게 되었을 경우 이를 측정할 수 있는 시스템을 만든 바 있다. 그 시스템과 연구 경험을 갖고 4500개 돌연변이 효모를 실험하는 작업을 NIH에 와서 시작했다. 엄청난 인내심이 필요한 연구였다.
그리고 그는 DNA 수리를 하는 단백질 10개를 새로 찾았다. 그때까지 사람들이 몰랐던 DNA 수리 단백질의 존재를 확인한 거다. 명 단장은 “효모에서 유전자를 발견하고, 이름을 Elg1(Enhanced Level of Genome instability 1)이라고 붙여줬다. Elg1 유전자와 사람의 DNA에서 똑같은 일을 하는, 즉 상동유전자가 ATAD5다”라고 말했다. 이 연구는 2004년 학술지 PNAS(미국과학회보)에 실렸다.
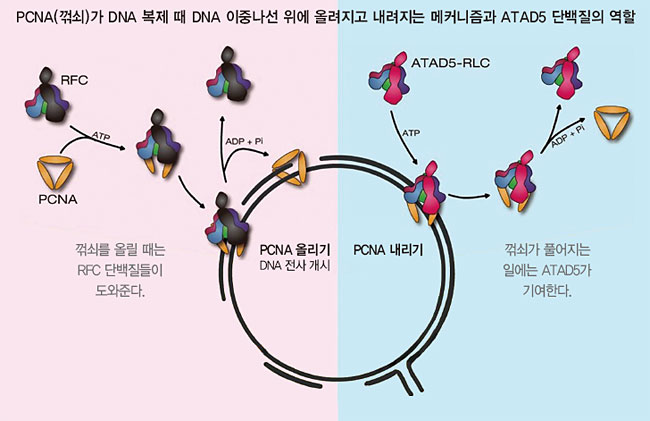
ATAD5 유전자는 무슨 일을 하는가? 명 단장은 “알고 보니 ATAD5 단백질은 혼자서 일을 하는 게 아니라 다른 단백질 4개와 같이 일을 하고 있었다. 여기서부터는 설명이 좀 복잡하다”라고 말했다. 명 단장에 따르면, 특정 유전자를 복사할 때는 그 부분의 DNA 이중나선이 벌어진다. 그러면 DNA 중합효소가 나선을 지나가면서 DNA 서열을 전사한다. DNA 중합효소가 안정적으로 복사를 하려면 나선에 잘 붙어 있어야 한다. 그걸 해주는 꺾쇠가 있다. 이 꺾쇠는 PCNA라고 하며, PCNA는 단백질 3개로 만들어져 있다. DNA 중합효소가 복사를 마치면 꺾쇠는 떨어져 나가야 한다. 이때 PCNA가 떨어지도록 꺾쇠를 벌리는 게 ATAD5 단백질이다. 혼자 꺾쇠를 풀어주는 일을 하는 게 아니고 RFC 2, 3, 4, 5라는 4개의 단백질과 같이한다. 이 연구는 2019년 학술지 ‘네이처커뮤니케이션’에 보고했다.
그가 찾아낸 DNA 수리 단백질 10개
그는 “이게 사실 중요한 연구”라며 설명을 계속했다. “DNA 중합효소가 전사를 시작할 때는 꺾쇠인 PCNA를 DNA 나선에 올려줘야 한다. PCNA가 나선에 올라갔다는 걸 보고, DNA 중합효소가 달려온다. 그러면 PCNA를 올리는 일은 누가 할까? 그 일은 RFC1 단백질이라는 게 한다. 즉 RFC1 단백질이 RFC 2, 3, 4, 5 단백질과 협업해서 올린다. 이건 옳다. 그런데 과거 일부 분자생물학 교과서는 올리는 건 물론이고 떼어내는 일도 RFC1이 RFC 2, 3, 4, 5와 같이한다라고 잘못 설명되어 있었다. 우리의 2019년 네이처커뮤니케이션에 보고한 연구는 이걸 바로잡았다.”
이 연구는 그가 미국 NIH 시절이 끝나던 2013년에 처음 논문을 냈다. 학술지 JCB(세포생물학저널)에 표지논문으로 가설을 제기했고 세포생물학 증거를 일부 제시했다. 이어 ATAD5가 PCNA란 꺾쇠를 떼어낸다는 걸 뒷받침하는 결정적 증거는 한국 IBS에 와서 실험으로 다 입증했다.
명 단장은 “ATAD5는 우리 연구실이 세계에서 가장 잘 안다고 자부한다. 2002년 첫 논문을 냈고, 2013년 JCB 표지논문으로 썼으며, 2019년 네이처커뮤니케이션에 결정적 증거를 제시했다. 그리고 제브라피시 연구를 진행하는 것도 ATAD5 유전자와 질병 및 노화와의 관계를 알아내기 위해서다”라고 말했다.
그는 ATAD5 유전자가 없는 쥐 모델을 만들었다. 그런데 쥐는 어미 뱃속에서 죽었다. 효모는 ATAD5가 없어도 죽지 않는다. 반면 제브라피시는 태어나기까지는 한다. 부화해서 7~8일은 산다. 그 차이가 뭘까? 그 이유는 하나의 세포로 출발해서 몸이 만들어지는 시간, 즉 발생에 필요한 시간이 동물마다 다르기 때문이다. 어미의 난자 안에는 새로운 생명의 발생에 필요한 RNA와 단백질이 일부 있다. 그걸로 제브라피시는 부화할 수 있다. 하지만 발생에 30일이나 걸리는 쥐는 난자가 갖고 있던 RNA와 단백질로 몸을 다 만들 수 없다. 어미 몸속에서 발생 7~8일 때 죽고 만다. 명 단장은 “ATAD5 유전자가 DNA 손상복구 말고, 몸 안에서 다른 일을 할 수 있다. 어느 조직에 있는 세포인가에 따라 ATAD5 유전자는 하는 일이 다르다고 생각한다. 그걸 보고 싶은데, ATAD5 돌연변이 쥐는 어미 뱃속에서 죽어버리니 쥐로는 연구할 수가 없었다. 그래서 제브라피시를 갖고 ATAD5 유전자가 하는 일이 무엇인가를 찾고 있다”라고 말했다.
ATAD5 유전자가 없는 제브라피시는 턱이 이상하고, 뇌가 작고, 혈액세포가 잘 안 만들어지는 특징을 보인다. 뇌가 작은 걸 보면 ATAD5가 뇌의 발달에 중요한 기능을 하겠구나라고 유추할 수 있다. 명 단장은 “이런 게 기초과학이다”라며 “ATAD5 유전자와 소뇌증 환자와의 관계를 보고하는 논문을 준비 중이다”라고 말했다. 그는 이어 “미국에 있었으면 이런 연구를 할 수 없었을 거다. IBS 유전체항상성연구단이 충분한 연구시설과 연구비를 지원받고 있기에 가능했다”라고 말했다.
ATAD5 유전자 연구는 암세포를 치료하는 항암제 연구로 가고 있다. 암세포는 분열을 미친 듯이 하는 게 특징이다. DNA 복제를 엄청나게 하기 때문에, 세포는 복제 스트레스를 받으며, ATAD5 단백질 생산을 늘린다. 이에 따라 특정 세포가 복제 스트레스를 많이 받는가 여부를 보려면, 세포 내 ATAD5 양을 확인하면 된다. ATAD5는 암세포를 찾아낼 수 있는 물질이 되었다. 명 단장은 갖고 있는 화합물과 ATAD5 단백질을 이용해 항암제를 찾고 있다. DNA 보수를 하는 PARP1 단백질을 갖고 유방암 치료제를 찾고 있다. 일부 성과는 이미 학술지에 보고하고 있다.
명 단장은 연구를 설명하는 데 지치지 않았다. 2시간이 훨씬 지났을 때 내 머리는 그의 설명을 잘 따라가지 못했다. 처리용량을 넘어서 그런지 잘 돌아가지 않았다. 결국 어느 선에서 끝내야 했다. 인터뷰를 마치고 돌아와 IBS 유전체항상성연구단 웹사이트를 다시 찾아보았다. ‘DNA 복구 메커니즘 규명으로 암과 노화에 해법 제시’라고 연구단의 목표가 제시되어 있다. 명경재 단장이 들려준 연구 이야기를 함축하는 문장이었다.
