
서울대 화학부 이윤호 교수는 미국에서 박사학위 공부할 때를 힘든 시간으로 기억한다. 지난 2월 10일 서울대 화학관에서 만난 이 교수는 “석사도 하지 않고 가서 그런지 존스홉킨스대학(지도교수 케네스 칼린)에서는 연구 경험이 부족한 학생이었다”라고 말했다. 이대로 가면 취업이나 할 수 있을까 조바심이 나기도 했다. “당시 칼린(Karlin) 교수님이 ‘얘는 재능이 없나 보다’라고 생각했을 것”이라고 그는 말했다.
박사학위를 받고 2007년 MIT(매사추세츠공과대학) 화학과의 조나스 피터스(Jonas Peters) 교수 랩으로 갔다. MIT에는 무기화학의 대가가 많았다. 그는 앞서 박사과정 때는 구리(Cu)와 산소(O₂)의 화학을 연구했고, MIT 피터스 교수 랩에서는 철(Fe)을 갖고 질소(N₂)를 활성화하는 연구를 했다. 이 교수는 “칼린 교수님이 정통적인 생(bio)무기화학 방법론을 이용한 연구를 했다면, 조나스 피터스 랩에서는 유기금속화학 방법론을 사용했다는 점이 달랐다”라고 말했다. 이 교수는 “MIT에서 인(P)과 규소(Si)를 리간드로 해서 금속 착물(metal complex)을 만들었다”라며 “안정한 물질인 질소가 철에 결합하고 환원되어 가는 것을 직접 볼 수 있어서 연구가 재밌었다”라고 말했다.
MIT에 온 지 6개월 지나자 연구 결과가 쏟아졌다. 존스홉킨스대학에서는 무기화학 학술지에 1년에 한 편 정도 논문을 냈는데, MIT에 3년간 있으면서는 학술지 ‘네이처케미스트리’(2010년)에 한 번, 미국화학회지(JACS)에는 2011년 한 해 논문을 두 번 발표했다. JACS는 화학자들이 가장 높이 평가하는 화학 전문 학술지다. 이 교수는 “MIT에서 성공스토리를 썼다”면서 “그렇다고 내가 칼린 교수 랩에서는 망하고, 피터스 랩에서는 성공했다는 건 아니다. 칼린 교수 랩에서 보낸 6년이 중요한 밑거름이 되었다”라고 말했다. 그는 “내 경험 덕분에 연구 실적이 잘 안 나오는 학생을 포기하지 않는다”라고 말했다.
이윤호 교수는 생무기화학자(bio-inorganic chemist)다. 그는 전북대 화학과 93학번. 유학을 준비하고 있을 때 갓 부임한 이동헌 교수로부터 이 분야를 접했고, 존스홉킨스대학으로 2001년 공부하러 갔다.
이윤호 교수는 “생무기화학에 ‘생(生)’ 자가 붙은 건, 무기화학자들이 생체 내 산소, 질소와 같은 소분자(small molecule) 활성 반응들이 철, 구리와 같은 전이금속으로 인해 일어남을 밝히기 위해 관련 연구를 시작하면서부터다”라고 말했다.
질소·산소를 금속과 결합시켜
질소나 산소를 어떻게 활성화한다는 것인가? 질소와 산소는 지구 대기에 가장 많은 물질이다. 많이 존재한다는 건 다른 물질과 반응하지 않는다는 뜻이다. 그 이유는 물질이 안정적이거나 활성화 에너지가 높기 때문이다. 활성화 에너지가 높다는 건 화학반응이 일어나기 위한 문턱 값이 높다는 얘기다. 그는 질소나 산소가 다른 물질과 반응하게 하는 마법을 알고 있다.
이 교수는 “나는 전이금속 착물의 전자 구조 전문가다. 산소나 질소가 금속에 결합하여 전자를 집어넣거나 빼앗음으로써 다른 물질과 반응하도록 한다. 그리고 전자 몇 개를 넣으면 어떤 효과가 있는지를 잘 이해하고 있다”라고 말했다. 전자를 빼앗거나 보태주면 전자 밀도가 변한다. 전자 밀도가 달라지면 질소의 극성(極性·polarity)과 같은 화학적 성질이 달라진다. 전자 밀도를 바꿈으로써 안정적이던 질소나 산소가 다른 금속과 반응하게 하며, 이걸 질소활성화(N₂-activation), 산소활성화(O₂-activation)라고 한다.
생물은 질소 및 산소 활성화를 통해 유기물을 생산하고 분해한다. ‘활성화’를 위해서는 금속이 필요한데, 생물은 귀금속을 사용하지 않는다. 자연은 철, 구리, 니켈과 같이 지각에 흔한 금속을 사용한다. 쉽게 구할 수 있는 금속을 갖고 생명 시스템을 돌리고 있다. 이 교수의 설명을 들어본다.
“에너지를 전환하고 활용하는 데 산소가 핵심적 역할을 한다. 유기물은 이론상 공기 중의 산소와 결합하면 CO₂로 전환되며 많은 에너지를 발생시킨다. 비슷하게 우리가 들이마신 산소는 단백질, 지방, 당과 같은 유기물의 대사과정에 관여한다. 유기물에서 에너지를 뽑아 쓰고, 생성된 CO₂를 호흡으로 배출한다. 유기물은 이론상 산소와 결합하면 CO₂로 바뀐다. 우리 몸속에서는 철이 포함된 시토크롬 c 산화효소(CcO·Cytochrome c Oxidase)가 산소를 활성화한다는 건 오래전부터 알려져 있었다. 식물의 광합성은 이와는 반대 과정이다. 식물은 CO₂와 물(H₂O)이라는 재료를 갖고 태양에너지를 가해 당과 산소를 만든다. 당은 식물 안에서 다양한 형태의 유기물로 바뀌어 에너지를 저장한다. 식물 잎에는 금속인 ‘망간(Mn)’과 산소의 결합 활성 자리가 있다. 산소발생복합체(OEC·Oxygen-Evolving Complex)라고 하는 자리에서 물이 산소로 바뀌고 그 산소는 공기 속으로 배출된다. 이 과정에서 양성자와 전자가 중요한 일을 한다. 전이금속이 포함된 CcO나 OEC의 반응을 연구하는 사람이 나와 같은 생무기화학 연구자다.”
자연이 지표에 흔한 금속으로 생명체를 돌아가게 하는 반면, 인간은 그런 기술을 배우지 못했다. 귀금속인 루테늄, 로듐, 팔라듐, 이리듐, 백금, 금을 사용하는 법만 익혔다. 귀금속으로 지난 100년간 산업을 돌려온 게 우리의 현주소다. 실리콘 물질에는 백금이 들어가고, 모바일 디스플레이에는 이리듐이 들어가는 게 한 예다.
값싼 금속 사용해 효율적 에너지 반응 추구
생무기화학자는 자연을 연구함으로써 귀금속이 아닌 값싼 금속을 사용해 에너지 관련 반응이 효율적으로 일어나게 하려고 한다. 물론 쉽지 않다. 대표적인 게 질소(N₂)를 암모니아로 바꾸는 화학반응이다. 일부 식물에 공생하는 박테리아는 공기 속의 질소를 갖고 암모니아(NH₃)를 만든다. 암모니아는 식량 증산에 필수적인 비료의 핵심 재료이다. 자연은 질소 고정을 상온에서 한다. 그러나 인간은 상온 질소 고정법을 모른다. 같은 일을 하기 위해 고온·고압의 조건이 필요하다. 이 방법이 유명한 하버-보슈법이다. 고온·고압의 조건을 만들려면 에너지가 대단히 많이 필요하다. 비료를 생산하기 위해 인류는 에너지 사용량의 1% 이상을 쓴다는 말이 있다. 이 교수는 “그러니 막대한 에너지 낭비가 있다. 또 언제까지 이럴 수는 없다. 우리가 꺼내 쓸 수 있는 에너지는 한계가 있기 때문이다. 생무기화학자는 생명체 안에서 어떤 일이 일어나고 있는가를 잘 보는 것이 중요하며, 기후변화와 환경오염 문제 해결을 위해 뭔가를 해야 한다”라고 말했다.
이윤호 박사는 2010년 카이스트 교수가 되었다. 그는 “한국으로 돌아오는 비행기 속에서, 세상에 도움이 되는 과학자가 되고 싶다는 생각을 했다. 당시 에너지와 환경 관련 핫이슈 중 하나가 CO₂ 전환이었다. CO₂를 CO로 바꾸는 연구를 카이스트에서 시작했다”라고 말했다.
CO₂는 탄소가 가장 산화된 형태다. 때문에 대기에서 매우 안정적이다. 다른 말로 하면 쓸모가 없다. 기후변화의 주범이기도 하다. 하지만 CO₂를 환원시켜 반응성이 높은 CO로 바꾼다면 피셔-트로프슈(Fischer-Tropsch) 공정, 옥소 공정(하이드로포밀화·hydroformylation)에서 활용이 가능하여 산업적으로 매우 유용하다. 그런데 CO는 반응성에서 오는 독성이 있어 이런 면들을 잘 이해하고 조절할 수 있어야 한다. 생체 안에는 CODH(CarbOn DeHydrogenase·CO 탈수소 효소)라는 효소가 있어, CO₂를 CO로 바꾸는 반응이 일어나게 한다. 이 교수는 CODH 효소가 하는 일을 이해하고, 똑같은 일을 일어나게 하는 촉매 개발에 들어갔다.
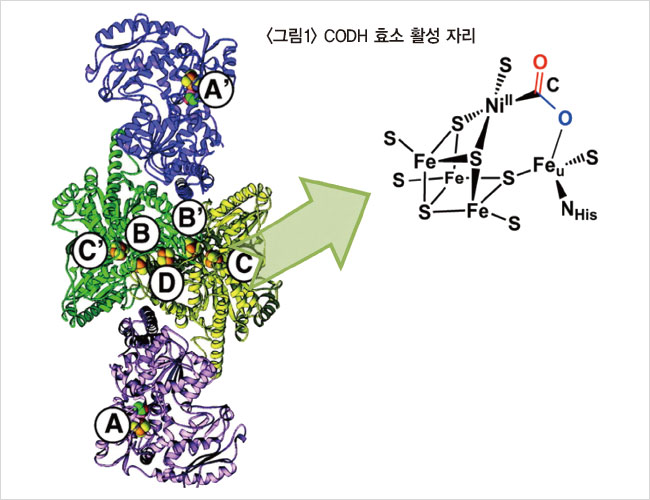
2010년 당시에는 CODH가 생체 안에서 일으키는 CO₂→CO 전환 반응에 대한 화학적 이해가 부족했다. 이 교수가 컴퓨터 모니터에 CODH 효소의 X선 단결정(Single Crystal) 구조를 보여준다.<그림1 참조> 실이 꼬여 있는 실타래 모양이다. 효소 내부에 CO₂가 결합되어 있을 때 그 결합 부위를 보면, CO₂ 내의 C는 니켈(Ni)에, CO₂ 내의 O(산소) 부분은 철(Fe)과 결합해 있다. 여기까지는 알려져 있었다. 이 교수는 “CO₂→CO 전환 메커니즘을 이해하지 못하니, 나는 단순한 질문부터 던졌다. 좋은 연구를 하기 위해서는 좋은 질문을 찾는 게 중요하다”라고 말했다. 그가 찾아낸 질문은 니켈이 어떤 상태에 있을 때 CO₂가 와서 결합하는가다.
니켈과 CO₂ 결합 결정하는 리간드
니켈이 어떤 상태일 때 CO₂가 와서 결합하는지는, 니켈을 둘러싼 리간드가 결정한다. 이 교수는 리간드를 디자인해야 했다. 니켈은 평면 구조를 좋아한다. 평면 구조는 T 자, Y 자일 수 있다. 생체 내 CODH 효소의 경우 니켈을 황(S) 원자 셋이 둘러싸고 결합해 있는 구조다. 이 교수 그룹은 황 대신에 조절하기가 쉬운 인(P)을 썼다. 연구 결과는 2013년 오가노메탈릭스와 2014년 케미칼커뮤니케이션이라는 학술지에 우선 보고할 수 있었다.
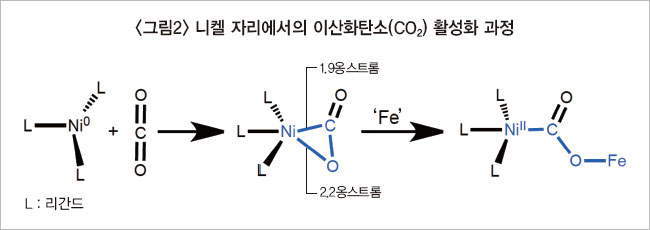
이 교수에 따르면 니켈에 인(P) 2개가 있는 리간드가 있고, 거기에 CO₂가 결합하는 구조는 1975년부터 알려져 있었다. 이 교수는 “사람들이 인이 2개인 것과 인이 3개인 것의 차이를 잘 모른다. 구조가 비슷하다고 그 중요성을 잘 몰랐으나, 그렇지 않다”라고 말했다. 인 3개를 가진 니켈 구조를 합성한 건 대학원생이던 김영은 박사다. 니켈 금속에 인(P) 3개를 붙이고, 그 축 방향 아래쪽으로 CO₂를 붙일 수 있었다. 그런 뒤 합성된 ‘니켈-CO₂’ 구조 안에서 니켈과 산소, 니켈과 탄소와의 거리를 측정했다.<그림2 참조> CO₂의 산소 원자 두 개 중 하나와 니켈 간의 거리는 2.2옹스트롬(10-10m)이고, CO₂ 안의 탄소(C)와 니켈과의 거리는 1.9옹스트롬이었다. 니켈로부터 산소가 탄소보다 멀리 떨어져 있다. 그러니 결합이 약하고 떨어져 나가기가 쉬웠다. 이때 CODH 안에 있는 다른 금속인 철(Fe)이 일을 한다. CO₂에서 떨어져 나온 산소(O) 하나가 철과 결합하는 것이다. 이 교수는 “정리를 해보면, 반응의 초기에는 니켈과 CO₂가 결합한다. 그리고 니켈과 산소 사이의 결합이 끊어지면서 철로 산소 하나가 옮겨간다. 이게 효소의 메커니즘에 포함된다”라고 말했다.
산소 하나는 떨어져 나갔으니 CO₂는 CO가 되었고, 금속인 니켈과 결합해 있다. 다음 작업은 CO를 니켈에서 떼어내는 것이다. 이 교수는 “니켈에 결합된 CO를 뜯어내야 하는데 그게 어렵다. 이 연구가 2018년 JACS 논문이 되었다”라고 말했다. JACS 논문을 쓰기 전까지는 고난의 행군을 더 해야 했다. 이 연구를 한 학생은, 지금 한국화학연구원에서 일하는 유창호 박사다.
이 교수는 “유창호 박사는 매우 똑똑하고 연구를 잘했다. 그런데 우리는 연구 착수로부터 4년이 된 2015년에도 원하는 결과를 얻지 못했다. 유 박사는 박사과정을 마무리해야 했고, 나는 정년심사를 걱정해야 했다”라고 말했다. 보고자 하는 선택적인(selective) CO₂ 전환 반응이 나오지 않아, 실패한 연구를 정리해서 학술지(Inorganic Chemistry Frontier)에 보고했다. 만든 화합물을 다 분리하고 구조 분석까지 한 걸 발표한 것이다.
그리고 궁리 속에 리간드 디자인을 다시 고쳤다. 리간드의 중앙에 있는 질소의 특징을 바꿔보기 위해 구조 조정을 했다. 흥미로운 결과가 나왔다. 새 리간드는 평평한 구조이고 딱딱해서 움직이지 않았다. 이전 디자인의 리간드가 낭창낭창 흔들렸던 것과는 달랐다. 새로운 리간드를 이용해 니켈 착물을 합성하고 특성을 알아 보니 선택성이 좋고 반응성이 좋은 금속 라디칼(radical)인 걸로 나왔다. 즉시 해당 결과를 독일화학회지(앙게반테 케미)에 보고할 수 있었다. 목표를 향해 걸어가다가 얻은 기분 좋은 부산물 연구였다.
2017년까지 니켈에 결합해 있는 CO를 떼는 방법을 찾지 못했다. CO는 환원된 니켈 촉매에 들러붙어 떨어지지 않았다. 이 교수는 니켈-CO 착물에 전자를 2개 넣은 후, CO₂를 넣으면 CO가 떨어져 나가는 방법을 떠올렸다. 그는 “CO를 떼어내기 위해서는 CO₂가 들어와야 한다는 게 내 메커니즘의 핵심”이라고 말했다.
새롭게 제안한 ‘게이트 오프닝’ 개념
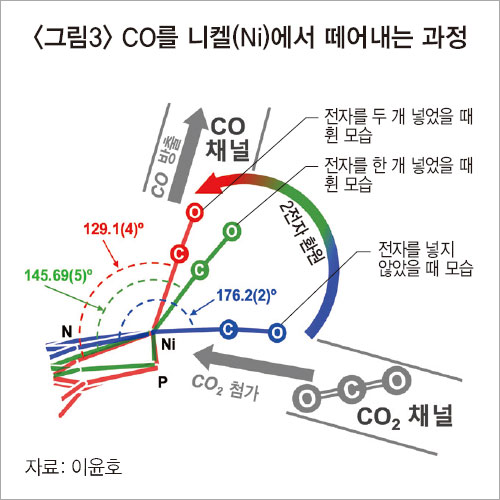
이 교수가 제안한 건 ‘게이트 오프닝(gate opening)’ 개념이다. 전자를 넣으면 CO가 평면 구조로 있다가 Z축 방향으로 올라간다.<그림3 참조> 전자를 더 넣으면 점점 더 올라간다. CO는 올라가고 앞이 열린다. 문(gate)이 열린 것이다. CO₂가 보기에는 다른 곳은 막혀 있으니, 열려 있는 데로 들어간다. 이윤호 교수 그룹은 결국 이 같은 걸 다 확인하고 CODH가 CO₂를 CO로 바꾸는 메커니즘을 다시 썼다.
이 교수가 2011년에 시작한 연구는 2018년에 마무리했다. 유창호 박사와, 새로 실험실에 들어온 인도 출신 박사후연구원이 함께 문제를 풀었다. 니켈 자리에서 CO₂가 선택적으로 결합하며 CO가 떨어져 나가는 것을 확인했다. 해당 결과를 기반으로 JACS와 또 다른 학술지(Accounts of Chemical Research)에 논문 두 편을 연달아 발표했다.
이 교수가 CO₂를 CO로 바꾸는 촉매를 개발한 건 아니다. 촉매라고 하려면 CO₂에서 CO로 가는 일련의 반응들이 일어나는 사이클이 돌아가도록 해야 한다. 그것도 한 바퀴만 돌아가서는 안 된다. 산업계에서 쓰려면 수만 번은 사이클이 돌아가야 한다. 이 교수 그룹이 해낸 것은 CO₂에서 CO로 전환되는 과정에서 생성되는 중간체가 무엇인지 확인하고, 그들을 모두 합성하여 CODH 니켈 효소 반응의 화학적 타당성을 확보한 것이다. 개별 단계는 만들어 보일 수 있으니, 전체 공정이 돌아가게 하는 촉매반응 개발이라는 또 다른 넘어야 할 산이 남아 있다.
이 교수의 화학 이야기를 오래 들으니 머리가 아팠다. 그는 사정을 봐주지 않았다. 자신의 연구 분야 3개가 더 있다며 설명을 계속했다. ‘금속-리간드 협동성 촉매반응’ 연구와, NOx(NO₃·NO₂·NO 등)을 질소분자(N₂)로 바꾼 연구, 그리고 구리 발광체 연구를 소개했다. 모두 흥미로운 주제였다.
그는 카이스트에서 10년간 일했다. 그리고 지난해 3월 서울대로 옮겨왔다. 서울대 화학관 내 그의 연구실은 신임 교원의 연구실인 듯 깨끗했다. 벽에는 화학식이 잔뜩 쓰여 있었다. 세상에 도움이 되고자 하는 꿈에 다가가기 위해 앞으로 그가 어떤 연구를 일궈낼까 궁금하다.
